Quelle est la différence entre l'époxydation et l'oxydation
Le différence clé entre l'époxydation et l'oxydation est que l'époxydation fait référence à la conversion d'un groupe de carbone à double liaison dans un groupe d'époxyde, tandis que l'oxydation se réfère à la combinaison d'oxygène avec une substance.
L'époxydation et l'oxydation sont des termes courants dans les réactions de synthèse organique. L'époxydation peut être décrite comme une forme spéciale d'oxydation qui donne spécifiquement un composé d'oxyde cyclique / composé d'époxyde.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'époxydation
3. Qu'est-ce que l'oxydation
4. Similitudes - époxydation et oxydation
5. Époxydation vs oxydation sous forme tabulaire
6. Résumé - Epoxydation vs oxydation
Qu'est-ce que l'époxydation?
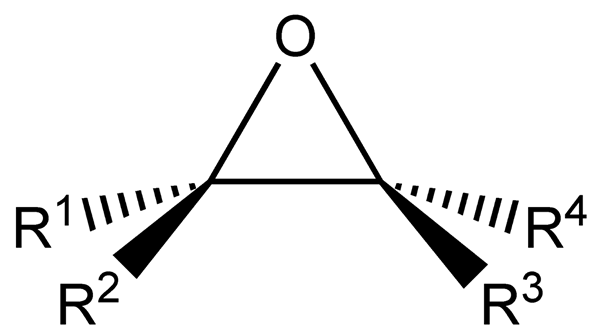
L'époxydation est le processus chimique qui peut convertir une liaison chimique C-C en une liaison d'époxyde. Un époxyde est un éther cyclique ayant les deux atomes de carbone d'une double liaison liée au même atome d'oxygène. Ces composés sont également appelés oxiranes.

Figure 01: Structure générale d'un époxyde
Nous pouvons créer un époxyde par la réaction entre les peracides et les atomes de carbone à double liaison. Dans les peracides, il existe une liaison oxygène-oxygène qui est non seulement faible mais aussi une liaison polarisée. Par conséquent, le groupe acyloxy dans ce composé a une charge négative, et le groupe hydroxyle a une charge positive. Cependant, il est peu probable qu'un intermédiaire dipolaire se forme, de sorte que les scientifiques pensent que cette réaction se produit en une seule étape à travers une transition qui intègre tous les événements de liaison chimique et de liaison en même temps.
Qu'est-ce que l'oxydation?
L'oxydation est le processus d'augmentation du nombre d'oxydation d'espèces chimiques. Cependant, il existe trois définitions distinctes pour ce terme; L'ajout d'oxygène, l'élimination de l'hydrogène ou la perte d'électrons signifie l'oxydation. Mais toutes ces définitions ont des exceptions à différentes occasions. Ainsi, nous utilisons la définition ci-dessus comme définition générale pour toutes les occasions.
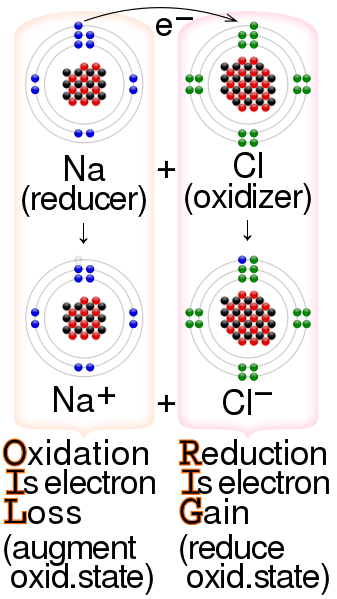
Figure 02: Réaction de réduction-oxydation
L'oxydation est un type de réaction redox. Une réaction redox a essentiellement deux réactions parallèles: les réactions d'oxydation et les réactions de réduction. Ces réactions impliquent toujours le transfert d'électrons entre deux espèces chimiques. De plus, les espèces chimiques qui subissent l'oxydation libèrent toujours des électrons, tandis que les espèces chimiques qui subissent une réduction obtiendront toujours ces électrons. Par conséquent, la libération d'électrons fait plus de protons qui n'ont pas d'électrons pour neutraliser leur charge. Ainsi, l'élimination des électrons augmentera le nombre d'oxydation des espèces chimiques.
Quelles sont les similitudes entre l'époxydation et l'oxydation?
- L'époxydation et l'oxydation sont des types de réactions d'oxydation qui impliquent l'ajout d'atomes d'oxygène aux composés organiques.
- Les deux réactions sont importantes dans les réactions de synthèse organique.
- Ces réactions donnent des types de composés d'oxyde comme produit final.
Quelle est la différence entre l'époxydation et l'oxydation?
L'époxydation et l'oxydation sont des termes courants dans les réactions de synthèse organique. La principale différence entre l'époxydation et l'oxydation est que l'époxydation se réfère à la conversion d'un groupe de carbone à double liaison en un groupe d'époxyde, tandis que l'oxydation se réfère à la combinaison d'oxygène avec une substance. Par conséquent, la réaction d'époxydation donne un époxyde comme produit final de la réaction, qui est un groupe cyclique impliquant un atome d'oxygène et deux atomes de carbone. D'un autre côté, l'oxydation donne un composé d'oxyde comme produit final, qui a une liaison carbone à l'oxygène non cyclique.
L'infographie suivante présente la différence entre l'époxydation et l'oxydation sous forme tabulaire.
Résumé - Epoxydation vs oxydation
L'époxydation et l'oxydation sont des termes courants dans les réactions de synthèse organique. La principale différence entre l'époxydation et l'oxydation est que l'époxydation se réfère à la conversion d'un groupe de carbone à double liaison en un groupe d'époxyde, tandis que l'oxydation se réfère à la combinaison d'oxygène avec une substance.
Référence:
1. «Epoxydation." Chemistry LibreTexts, LibreTexts, 13 septembre. 2020.
Image gracieuseté:
1. «Epoxyde Generic» de Tomas Kindahl - Propre travaux (domaine public) via Commons Wikimedia
2. «Exemple redox» par Cmglee - propre travail (CC BY-SA 4.0) via Commons Wikimedia


