Différence entre le travail et la chaleur
Le différence clé entre le travail et la chaleur est que Le travail est le mouvement ordonné dans une direction tandis que la chaleur est le mouvement aléatoire des molécules.
Le travail et la chaleur sont les deux concepts les plus importants de la thermodynamique. Le travail et la chaleur sont très interdépendants les uns aux autres mais ils ne sont pas tout à fait les mêmes. La quête pour comprendre le travail et la chaleur remontent bien à. Avec ces deux concepts effacés, la thermodynamique classique est devenue l'un des domaines «complétés» en physique. La chaleur et le travail sont des concepts d'énergie. Les théories de la chaleur et du travail ont une énorme signification dans la thermodynamique, la mécanique des moteurs et les machines.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le travail
3. Qu'est-ce que la chaleur
4. Comparaison côte à côte - Travailler vs chaleur sous forme tabulaire
5. Résumé
Qu'est-ce que le travail?
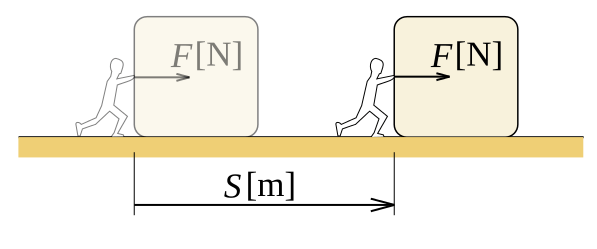
En physique, nous définissons le travail comme la quantité d'énergie transférée par une force agissant sur une distance. Le travail est une quantité scalaire, ce qui signifie qu'il n'y a qu'une ampleur pour travailler, une direction n'est pas présente. Considérez un objet que nous traînons sur une surface rugueuse. Il y a des frottements agissant sur l'objet. Pour les points donnés A et B, un nombre infini de chemins existent entre eux, il y a donc infiniment de nombreux itinéraires pour prendre la boîte de A à B. Si la distance parcourue l'objet lorsque nous le prenons sur un certain chemin est, S, le travail effectué par friction sur la boîte est F.s, (considérant uniquement les valeurs scalaires). Différents chemins ont des valeurs X différentes. Par conséquent, le travail effectué est différent.
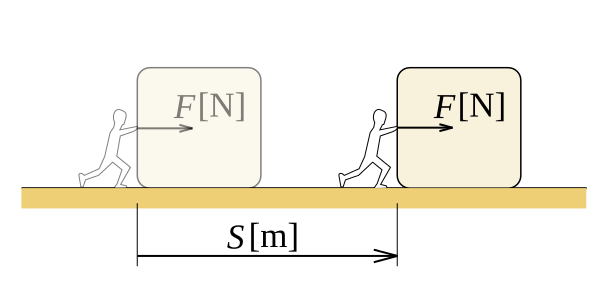
Figure 01: Travail effectué lors du déplacement de la distance «S» de l'objet avec une force «F»
Nous pouvons prouver que le travail dépend du chemin emprunté, ce qui signifie que le travail est fonction du chemin. Pour un domaine de la force conservatrice, nous pouvons prendre le travail effectué en fonction de l'État. L'unité de travail SI est Joule, nommée en l'honneur du physicien anglais James Joule. L'unité de travail CGS est ERG. Dans la thermodynamique, lorsque nous disons le travail, nous nous référons généralement au travail de pression, car la pression interne ou externe est le générateur de force qui fait le travail. Dans une situation de pression constante, le travail effectué est p.ΔV, où p est la pression et ΔV est le changement de volume.
Qu'est-ce que la chaleur?
La chaleur est une forme d'énergie. Nous pouvons le mesurer à Joule. La première loi de la thermodynamique concerne la conservation de l'énergie. Il indique que la chaleur fournie à un système est égale à l'incrément d'énergie interne de ce système plus le travail effectué par le système sur l'environnement. Ainsi, cela montre que nous pouvons convertir la chaleur en travail, et vice versa.

Figure 02: Le feu produit de l'énergie thermique
De plus, nous pouvons définir la chaleur comme l'énergie stockée comme un mouvement aléatoire de molécules ou d'atomes. La quantité de chaleur dans un système ne dépend que de l'état dans lequel se trouve le système; Par conséquent, la chaleur est fonction de l'état.
Quelle est la différence entre le travail et la chaleur?
Le travail est la quantité d'énergie transférée par une force agissant sur une distance tandis que la chaleur est une forme d'énergie. La principale différence entre le travail et la chaleur est que le travail est le mouvement ordonné dans une direction tandis que la chaleur est le mouvement aléatoire des molécules. De plus, le travail est fonction du chemin, mais la chaleur est fonction de l'état.
Comme une autre différence importante entre le travail et la chaleur, nous pouvons prouver que le travail peut être totalement converti en chaleur, mais la chaleur ne peut pas être convertie à 100% en travail. De plus, la chaleur est une forme d'énergie, tandis que le travail est une méthode de transfert d'énergie. L'infographie ci-dessous sur la différence entre le travail et la chaleur donne une comparaison plus détaillée.
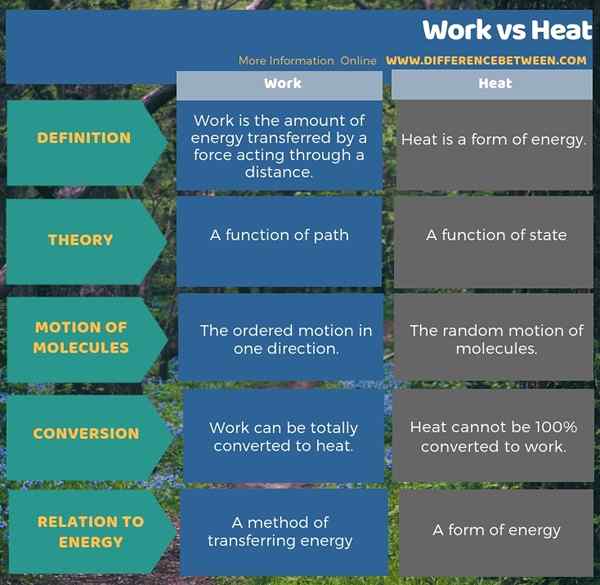
Résumé - Travail vs chaleur
Le travail et la chaleur sont des concepts que nous utilisons en physique et en chimie. Le travail et la chaleur sont interdépendants mais il existe également des différences entre elles. La principale différence entre le travail et la chaleur est que le travail est le mouvement ordonné dans une direction tandis que la chaleur est le mouvement aléatoire des molécules.
Référence:
1. OpenStaxCollege. «Physique collégiale.»Introduction à la sociologie - 1ère édition canadienne, Bccampus, 23 janvier. 2012. Disponible ici
2. Jones, Andrew Zimmerman. «Une façon scientifique de définir l'énergie thermique.”Thoughtco, oct. 11, 2018. Disponible ici
Image gracieuseté:
1.«Travail (physique)» par すじにく シチュー シチュー シチュー - propre travail, (CC0) via Commons Wikimedia
2."624524" (CC0) via pxhere


