Différence entre la liaison ionique et la liaison métallique
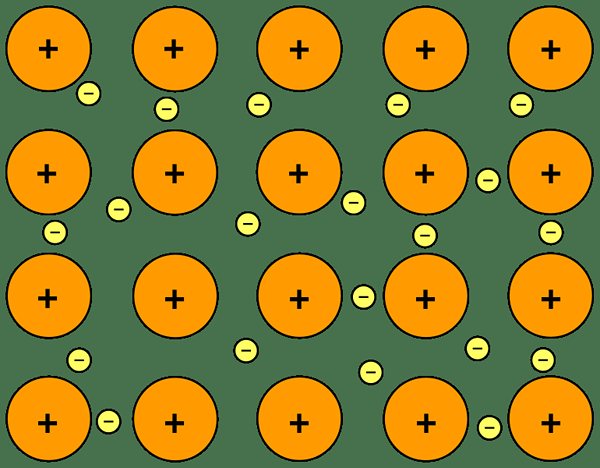
Le différence clé entre la liaison ionique et la liaison métallique est que le La liaison ionique se déroule entre les ions positifs et négatifs tandis que la liaison métallique a lieu entre les ions positifs et les électrons.
En tant que chimiste américain G.N.Lewis a proposé, les atomes sont stables lorsqu'ils contiennent huit électrons dans leur coquille de valence. La plupart des atomes ont moins de huit électrons dans leurs coquilles de valence (à l'exception des gaz nobles dans le groupe 18 du tableau périodique); Par conséquent, ils ne sont pas stables. Ces atomes ont tendance à réagir les uns avec les autres pour devenir stables. Ainsi, chaque atome peut atteindre une configuration électronique à gaz noble. Cela se produit en formant des liaisons ioniques, des liaisons covalentes ou des liaisons métalliques.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le lien ionique
3. Qu'est-ce que le lien métallique
4. Comparaison côte à côte - liaison ionique vs liaison métallique sous forme tabulaire
5. Résumé
Qu'est-ce que le lien ionique?
Les atomes peuvent gagner ou perdre des électrons et former respectivement des particules chargées négatives ou positives. Ces particules sont des «ions». Il y a des interactions électrostatiques entre ces ions. En conséquence, la liaison ionique est la force d'attraction entre ces ions chargés de facturation opposés.
L'électronégativité des atomes dans une liaison ionique influence la force des interactions électrostatiques. Par conséquent, l'électronégativité donne une mesure de l'affinité des atomes pour les électrons. Un atome à haute électronégativité peut attirer des électrons d'un atome à faible électronégativité pour former une liaison ionique.
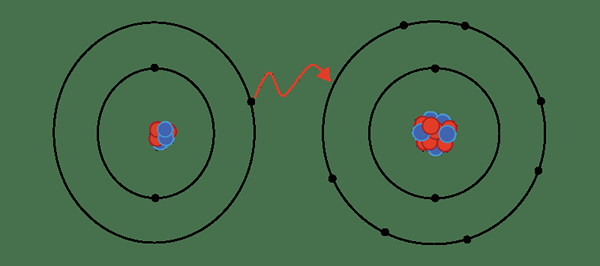
Figure 01: liaison ionique
Par exemple, le chlorure de sodium a une liaison ionique entre l'ion sodium et l'ion chlorure. Le sodium est un métal; Par conséquent, il a une électronégativité très faible (0.9) par rapport au chlore (3.0). En raison de cette différence d'électronégativité, le chlore peut attirer un électron de sodium et former CL- et na+ ions. Pour cette raison, les deux atomes gagnent la configuration électronique à gaz noble stable. CL- et na+ sont maintenus ensemble par des forces électrostatiques attrayantes, formant ainsi une liaison ionique.
Qu'est-ce que le lien métallique?
Les métaux sont des atomes, qui peuvent former des cations en éliminant les électrons. Les éléments du groupe 1, du groupe 2 et de la transition sont des métaux. La plupart du temps, les métaux sont en phase solide. Le type de formes de liaison entre les atomes métalliques est la «liaison métallique».
Les métaux libèrent des électrons dans leurs coquilles extérieures et ces électrons se dispersent entre les cations métalliques. Par conséquent, nous l'appelons une «mer d'électrons délocalisés». Les interactions électrostatiques entre les électrons et les cations sont appelées liaison métallique.

Figure 02: liaison métallique
Le nombre d'électrons que les atomes métalliques libèrent dans la mer et la taille du cation détermine la force de la liaison métallique. La taille des cations est inversement proportionnelle à la résistance de la liaison, ainsi que le nombre d'électrons qu'un atome métallique libère est directement proportionnel à la résistance à la liaison métallique.
De plus, les électrons peuvent se déplacer; Ainsi, les métaux ont la capacité de conduire l'électricité. En raison des métaux de liaison métalliques ont une structure ordonnée. Des points de fusion élevés et des points d'ébullition des métaux sont également dus à cette forte liaison métallique. Les métaux sont forts et pas fragiles, pour la même raison.
Quelle est la différence entre la liaison ionique et la liaison métallique?
La liaison ionique est un type de liaison chimique qui se produit entre deux ions chargés opposés tandis que la liaison métallique est le type de liaison chimique qui se produit dans un réseau métallique. Par conséquent, la principale différence entre la liaison ionique et la liaison métallique est que la liaison ionique se déroule entre les ions positifs et négatifs tandis que la liaison métallique a lieu entre les ions positifs et les électrons.
Comme autre différence importante entre la liaison ionique et la liaison métallique, nous pouvons considérer l'influence de l'électronégativité des atomes sur la force de liaison. C'est-à-dire; L'électronégativité n'a aucune influence sur la liaison métallique, car le même type d'atomes est impliqué dans la liaison, mais la force de la liaison est fortement influencée par la différence d'électronégativité entre les ions positifs et négatifs dans la liaison ionique. De plus, la liaison ionique est beaucoup plus forte que la liaison métallique.
L'infographie ci-dessous sur la différence entre la liaison ionique et la liaison métallique montre plus de différences entre les deux obligations.
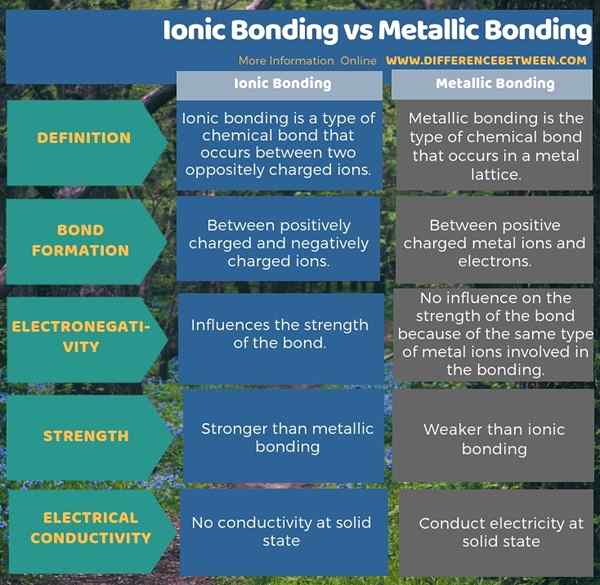
Résumé - Bondage ionique vs liaison métallique
Il existe trois principaux types de liaisons chimiques. Ils sont la liaison ionique, le liaison covalente et le collage métallique. La principale différence entre la liaison ionique et la liaison métallique est que la liaison ionique se déroule entre les ions positifs et négatifs tandis que la liaison métallique a lieu entre les ions positifs et les électrons.
Référence:
1. LibreTexts. «Boulois ioniques et covalentes.”Chemistry LibreTexts, National Science Foundation, 28 février. 2018. Disponible ici
2. LibreTexts. «Bondage métallique.”Chemistry LibreTexts, National Science Foundation, 31 juillet 2018. Disponible ici
Image gracieuseté:
1.«Bond ionique» par Eliseetc - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia
2.«Bondage métallique» par Muskid - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


