Différence entre le carbonate de sodium et le percarbonate de sodium

Le différence clé entre le carbonate de sodium et le percarbonate de sodium est que Le carbonate de sodium est une molécule unique tandis que le percarbonate de sodium est un adduit de carbonate de sodium et de peroxyde d'hydrogène.
Le carbonate de sodium et le percarbonate de sodium sont des composés inorganiques importants. Le percarbonate de sodium est un dérivé du carbonate de sodium tel qu'il se forme par l'ajout direct de deux composés: carbonate de sodium et peroxyde d'hydrogène.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le carbonate de sodium
3. Qu'est-ce que le percarbonate de sodium
4. Comparaison côte à côte - carbonate de sodium vs percarbonate de sodium sous forme tabulaire
5. Résumé
Qu'est-ce que le carbonate de sodium?
Le carbonate de sodium est un composé inorganique ayant la formule chimique Na2CO3. Le nom commun de ce composé est de laver le soda. Parfois, nous l'appelons aussi comme un tein de soda. Il a également divers hydrates. Le carbonate de sodium et ses hydrates apparaissent sous forme de solides de couleur blanche. De plus, tous sont solubles dans l'eau. De plus, ce composé a un fort goût alcalin. Lorsqu'il est dissous dans l'eau, il donne une solution modérément alcaline. De plus, c'est très hygroscopique.

Figure 01: Aspect du carbonate de sodium
La masse molaire de carbonate de sodium est 105.9 g / mol. La pinte de fusion de la forme anhydre est de 851 ° C. Nous pouvons produire du carbonate de sodium via des dépôts minéraux miniers (évaporites) ou via le processus Solvay. Lorsque vous envisagez les utilisations de ce composé, les principales applications sont dans la fabrication du verre, du papier, de la rayonne, des savons, des détergents, etc. De plus, il est utile pour le ramollissement de l'eau en éliminant les ions de magnésium et de calcium. C'est aussi un additif alimentaire majeur.
Qu'est-ce que le percarbonate de sodium?
Le percarbonate de sodium est un adduit de carbonate de sodium et de peroxyde d'hydrogène. La formule chimique de ce composé est na2H3CO6. Puisqu'il s'agit d'un adduit de deux molécules, nous pouvons écrire la formule comme 2NA2CO3.3h2O2. De plus, il s'agit d'un matériau solide incolore qui est cristallin et hygroscopique. La masse molaire est de 156.9 g / mol.
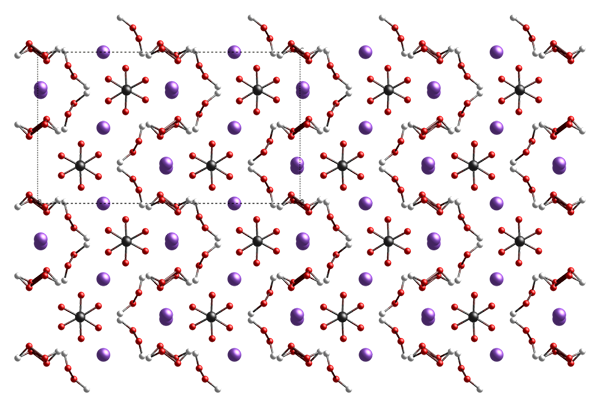
Figure 02: Structure du percarbonate de sodium
Nous pouvons faire ce composé en laboratoire via la cristallisation du carbonate de sodium et du peroxyde d'hydrogène sous des concentrations de pH et de réactifs contrôlés. Les applications du percarbonate de sodium comprennent l'utilisation comme agent oxydant, comme ingrédient dans les détergents, et dans les processus de synthèse organique comme source de peroxyde d'hydrogène anhydre.
Quelle est la différence entre le carbonate de sodium et le percarbonate de sodium?
Le carbonate de sodium est un composé inorganique ayant la formule chimique Na2CO3 tandis que le percarbonate de sodium est un adduit de carbonate de sodium et de peroxyde d'hydrogène. La principale différence entre le carbonate de sodium et le percarbonate de sodium est que le carbonate de sodium est une molécule unique tandis que le percarbonate de sodium est un adduit de carbonate de sodium et de peroxyde d'hydrogène. De plus, le carbonate de sodium est un solide blanc, tandis que le percarbonate de sodium est un solide cristallin incolore.
De plus, une autre différence entre le carbonate de sodium et le percarbonate de sodium est leur utilisation. Le carbonate de sodium est utile dans la fabrication de verre, de papier, de rayonne, de savons, de détergents, etc. et est également utile pour l'adoucissement de l'eau en éliminant les ions de magnésium et de calcium, et en tant qu'additif alimentaire majeur. En revanche, le percarbonate de sodium est utilisé comme agent oxydant, comme ingrédient dans les détergents, dans les processus de synthèse organique comme source de peroxyde d'hydrogène anhydre, etc.
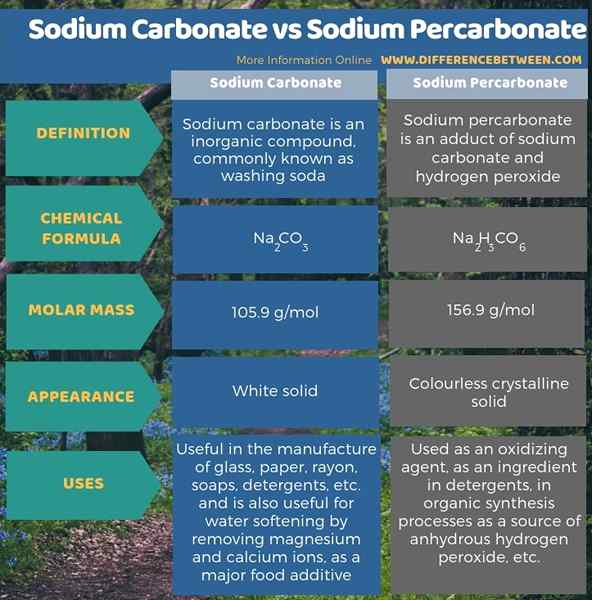
Résumé - Carbonate de sodium vs percarbonate de sodium
Le percarbonate de sodium est un dérivé du carbonate de sodium. La principale différence entre le carbonate de sodium et le percarbonate de sodium est que le carbonate de sodium est une molécule unique tandis que le percarbonate de sodium est un adduit de carbonate de sodium et de peroxyde d'hydrogène.
Référence:
1. Brandt, Malcolm J., et al. «Stockage chimique, dosage et contrôle." Approvisionnement en eau des tworts, 2017, pp. 513-552., doi: 10.1016 / B978-0-08-100025-0.00012-0.
Image gracieuseté:
1. «Uhličitan sodný» par Ondřej Manggl - propre travail (domaine public) via Commons Wikimedia
2. «Sodium-Percarbonate-XTAL-100K-2003-CM-3D-BALLS» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


