Différence entre le dipôle de la liaison et le dipôle moléculaire
Le différence clé BEntre le dipôle liaison et le dipôle moléculaire est que Le dipôle de la liaison se réfère à la création de deux extrémités polaires dans une liaison chimique particulière. Tandis que le dipôle moléculaire se réfère à la création de deux extrémités polaires dans un composé chimique particulier.
Les termes du dipôle de liaison et du dipôle moléculaire sont importants pour déterminer les propriétés chimiques et physiques d'un composé chimique. Un dipôle est l'état d'avoir deux extrémités avec une polarité différente existant dans la même liaison chimique ou composé chimique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un dipôle de liaison
3. Qu'est-ce qu'un dipôle moléculaire
4. Comparaison côte à côte - Dipôle de liaison vs dipôle moléculaire sous forme tabulaire
5. Résumé
Qu'est-ce qu'un dipôle de liaison?
Un dipôle de liaison est la présence de deux extrémités chargées opposées dans la même liaison chimique. Un moment dipolaire de liaison est un moment dipolaire électrique où il y a une charge positive et une charge négative dans la même liaison chimique. Cette séparation de charges se produit en raison de la polarité de la liaison chimique. Nous pouvons désigner le dipôle de Bond comme «». Nous pouvons donner le dipôle de la liaison en fonction de la charge électrique partielle de la liaison qui est donnée par «δ», et la distance entre les extrémités chargées données par «D» comme suit:
= Δd
Un dipôle de liaison est un vecteur parallèle à l'axe de liaison et ses points de moins (charge négative) à plus (charge positive). Cependant, en chimie, nous dessinons généralement ce vecteur pointant de plus à moins, afin d'indiquer le mouvement physique des électrons.
L'unité SI pour la mesure d'un dipôle de liaison est Coulomb-Metter. Pratiquement, cette unité ne convient pas car elle donne des valeurs trop importantes. Par conséquent, nous pouvons utiliser l'unité Debye avec le symbole «D» qui utilise la charge en (10-dix x) statcuolombs et distance en angstroms.

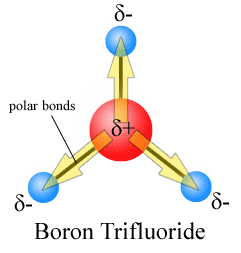
Figure 01: indiquant les dipôles de liaison dans une molécule avec trois liaisons chimiques
Pour les molécules polyatomiques, le dipôle de la liaison est une caractéristique d'une liaison chimique particulière dans la molécule. Pour les molécules diatomiques, il n'y a qu'une seule liaison entre deux atomes; Ainsi, le dipôle de liaison et le dipôle moléculaire sont les mêmes.
Qu'est-ce que le dipôle moléculaire?
Le dipôle moléculaire est la présence de deux extrémités chargées opposées dans la même molécule. Ce type de moment dipolaire survient en raison de la polarité nette de la molécule. La polarité nette ou la polarité globale d'une molécule s'accompagne de l'effet de la forme de la molécule et de la polarité de chaque liaison chimique.
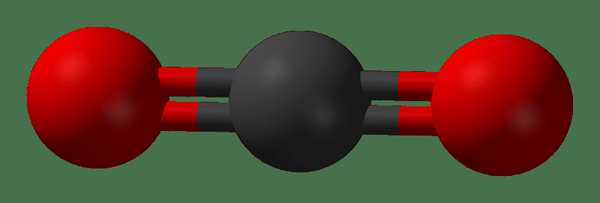
Figure 02: Structure de la molécule de dioxyde de carbone
Parfois, une molécule ayant des liaisons chimiques polaires peut ne pas avoir de polarité nette en raison de la forme qui équilibre la polarité nette pour être nul. Par exemple, une molécule linéaire avec deux liaisons polaires. Ici, les vecteurs de moment dipolaire des deux obligations annulent. E.g. gaz carbonique.
Quelle est la différence entre le dipôle de la liaison et le dipôle moléculaire?
La principale différence entre le dipôle de la liaison et le dipôle moléculaire est que le terme dipôle de liaison se réfère à la création de deux extrémités polaires dans une liaison chimique particulière, tandis que le terme dipôle moléculaire se réfère à la création de deux extrémités polaires dans un composé chimique particulier. En d'autres termes, un dipôle de liaison est donné pour une liaison particulière dans une molécule, tandis que le dipôle moléculaire est donné pour un composé chimique particulier.
En dessous de l'infographie résume la différence entre le dipôle de la liaison et le dipôle moléculaire.
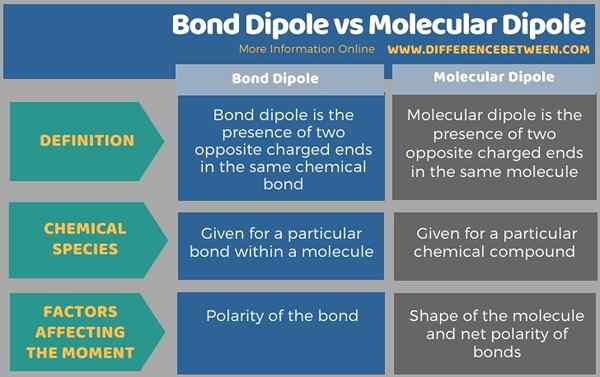
Résumé - Dipôle de liaison vs dipôle moléculaire
Le dipôle des liaisons et le dipôle moléculaire sont deux termes qui sont importants dans la détermination des propriétés chimiques et physiques des espèces chimiques. La principale différence entre le dipôle de la liaison et le dipôle moléculaire est que le terme dipôle de liaison se réfère à la création de deux extrémités polaires dans une liaison chimique particulière tandis que le terme dipôle moléculaire se réfère à la création de deux extrémités polaires dans un composé chimique particulier.
Référence:
1. «Moments dipolaires.”Chemistry LibreTexts, LibreTexts, 30 septembre. 2019, disponible ici.
2. «Moment dipolaire de liaison.”Wikipedia, Wikimedia Foundation, 17 décembre. 2019, disponible ici.
Image gracieuseté:
1. «Polarity Boron Trifluorure» par Emma Farmer (Séréphine à Anglais Wikipedia) - Créé avec Adobe Photoshop (domaine public) via Commons Wikimedia
2. «Carbon-dioxyde-3D-balls» par Benjah-BMM27 - propre travail (domaine public) via Commons Wikimedia


