Différence entre la borazine et le diborane
Le différence clé entre la borazine et le diborane est que La borazine contient trois atomes de bore par molécule, tandis que le diborane contient deux atomes de bore par molécule.
La borazine et le diborane sont des composés chimiques contenant du bore. Ce sont des composés cycliques avec différents nombres de membres de l'anneau.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la borazine
3. Qu'est-ce que Diborane
4. Comparaison côte à côte - borazine vs diborane sous forme tabulaire
5. Résumé
Qu'est-ce que la borazine?
La borazine est un composé cyclique et inorganique ayant la formule chimique B3H6N3. C'est un composé cyclique avec une structure d'anneau à six chaînons. C'est-à-dire qu'il a trois unités B-H et trois unités N-H dans un motif en alternance. Par conséquent, nous pouvons écrire sa formule chimique comme (bh3) (NH3). De plus, cette structure est isoélectronique avec l'anneau de benzène. Comme le benzène, c'est aussi un liquide incolore à température ambiante. Par conséquent, nous l'appelons parfois «benzène inorganique».
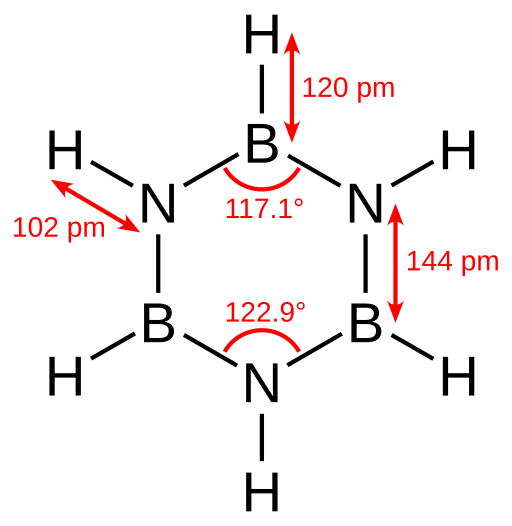
Figure 01: Structure de la borazine
De plus, la masse molaire de borazine est de 80.50 g / mol. Le point de fusion et les points d'ébullition sont respectivement de -58 ° C et 53 ° C. Il a également une odeur aromatique. De plus, il s'agit d'un composé synthétique que nous pouvons produire à partir de diborane et d'ammoniac à 1: 2.
La réaction chimique impliquée dans ce processus est la suivante:
3 b2H6 + 6 NH3 → 2 B3H6N3 + 12 h2
Surtout, si nous ajoutons de la borazine à l'eau, il hydrolysera pour donner de l'acide borique, de l'ammoniac et de l'hydrogène gazeux. De plus, ce composé est thermiquement très stable en raison de son faible changement d'enthalpie standard de formation; −531 kJ / mol. Comparé au benzène, la borazine est beaucoup plus réactive. Par exemple, il peut réagir avec le chlorure d'hydrogène tandis que le benzène ne peut pas.
Selon les déterminations cristallographiques aux rayons X, les longueurs de liaison dans la structure de l'anneau de la borazine sont égales. Cependant, il ne peut pas former un hexagone parfait car le modèle alterné de l'azote et du bore donne différents angles de liaison et donc, une symétrie moléculaire distincte.
Qu'est-ce que Diborane?
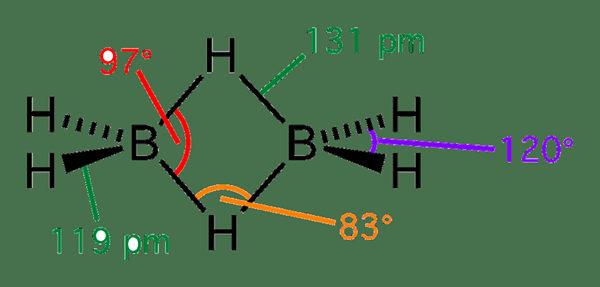
Le diborane est un composé inorganique ayant la formule chimique B2H6. Ce composé contient des atomes de bore et d'hydrogène dans une structure cyclique. Il se produit comme un gaz incolore et pyrophorique. Il a aussi une odeur douce répulsive. La masse molaire de diborane est 27.67 g / mol.

Figure 02: Structure du diborane
Le diborane est considéré comme une molécule déficient en électrons. En effet. De plus, c'est la raison de la structure cyclique ou pontée de la molécule de diborane.
Lorsque vous envisagez les propriétés du diborane, c'est un gaz incolore et inflammable à température ambiante. C'est aussi un gaz toxique. Lorsqu'il est brûlé en présence d'oxygène dans l'air, le diborane peut libérer une grande quantité d'énergie. Lorsque ce gaz est mélangé avec de l'eau, il hydrolyse rapidement, donnant de l'acide borique et de l'hydrogène gazeux.
Quelle est la différence entre la borazine et le diborane?
La principale différence entre la borazine et le diborane est que la borazine contient trois atomes de bore par molécule, tandis que le diborane contient deux atomes de bore par molécule. De plus, une autre différence entre la borazine et le diborane est que la borazine est un liquide incolore, tandis que le diborane est un gaz incolore et inflammable. De plus, la borazine est formée à partir de la réaction entre le diborane et l'ammoniac tandis que le diborane est formé à partir de la réaction entre les hydrures métalliques et le boron.
Vous trouverez ci-dessous une tabulation de la différence entre la borazine et le diborane.
Résumé - Borazine vs Diborane
La borazine et le diborane sont des structures cycliques. La principale différence entre la borazine et le diborane est que la borazine contient trois atomes de bore par molécule, tandis que le diborane contient deux atomes de bore par molécule.
Référence:
«Diborane - Structure du diborane, préparation, propriétés, utilisations.”ByJus, Byju's, 16 décembre. 2019, disponible ici.
«Diborane.»Wikipedia, Wikimedia Foundation, 6 février. 2020, disponible ici.
Image gracieuseté:
1. «Borazine-dimensions-2d» par HBF878 - Propre travaux (CC0) via Commons Wikimedia
2. «Diborane-2d» (domaine public) via Commons Wikimedia


