Différence entre l'énergie de la première et de la deuxième ionisation (i1e vs i2e)
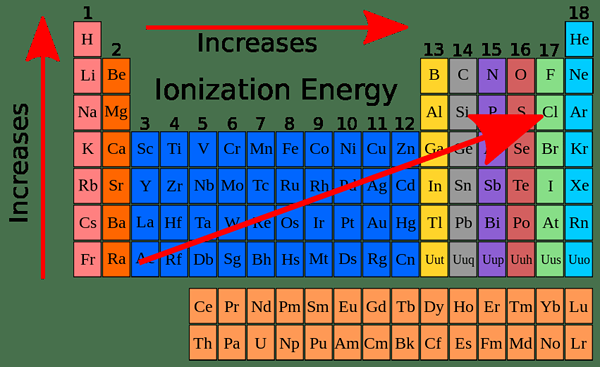
Différence clé - First vs Second Ionisation Energy (I1E vs I2E)
Avant d'analyser la différence entre la première et la deuxième énergie d'ionisation, discutons d'abord de l'énergie d'ionisation. En général, l'énergie d'ionisation est appelée l'énergie nécessaire pour éliminer un électron d'un atome gazeux ou un ion. Étant donné que les électrons sont attirés par le noyau positif, l'énergie doit être fournie pour ce processus. Ceci est considéré comme un processus endothermique. Les énergies d'ionisation sont exprimées en kj mol-1. Le différence clé Entre la première et la deuxième ionisation, l'énergie s'explique mieux dans leurs définitions; L'énergie absorbée par un atome gazeux neutre pour produire un ion chargé +1 (pour éliminer un électron) est appelé première énergie d'ionisation alors que L'énergie absorbée par un ion gazeux chargé (+1) positivement pour produire de l'ion avec une charge de +2 est appelé la deuxième énergie d'ionisation. L'énergie d'ionisation est calculée pour 1 mol d'atomes ou d'ions. Autrement dit; La première énergie d'ionisation concerne les atomes gazeux neutres et l'énergie de la seconde ionisation se rapporte aux ions gazeux avec une charge (+1). L'ampleur de l'énergie d'ionisation varie en fonction de la charge du noyau, de la distance de la forme électronique du noyau et du nombre d'électrons entre le noyau et les électrons de la coque externe.
Quelle est l'énergie de la première ionisation (i1E)?
La première énergie d'ionisation est définie comme l'énergie absorbée par 1 mol d'atomes gazeux neutres pour éliminer l'électron le plus lâchement lié de l'atome pour produire 1 mol d'ions gazeux avec une charge +1. L'ampleur de l'énergie de première ionisation augmente le long d'une période dans le tableau périodique et diminue le long d'un groupe. L'énergie de première ionisation a une périodicité; il a le même motif à plusieurs reprises le long du tableau périodique.
Qu'est-ce que l'énergie de la seconde ionisation (i2E)?
La deuxième énergie d'ionisation est définie comme l'énergie absorbée par 1 mol d'ions gazeux chargés positivement chargés pour produire 1 mol d'ions gazeux avec une charge de +2, en éliminant l'électron lié à un ion +1. L'énergie de la seconde ionisation montre également une périodicité. 
Quelle est la différence entre la première et la deuxième énergie d'ionisation (i1E et moi2E)?
Définition de Première et deuxième énergie d'ionisation
Énergie de première ionisation (i1E): L'énergie nécessaire pour éliminer l'électron le plus lié à 1 mol d'atomes gazeux pour produire 1 mol d'ions gazeux avec une charge positive (+1).
X (g) X+ (g) + e-
(1 mol) (1 mol) (1 mol)
Deuxième énergie d'ionisation (i2E): L'énergie nécessaire pour éliminer l'électron le plus lié à 1 mol d'ions gazeux avec une charge de +1 pour produire des ions gazeux avec une charge +2 avec une charge de +2.
X+ (g) X2+ (g) + e-
(1 mol) (1 mol) (1 mol)
Caractéristiques de la première et de la deuxième énergie d'ionisation
Exigence énergétique
Expulser généralement le premier électron d'un atome gazeux à l'état fondamental est plus facile que d'expulser le deuxième électron à partir d'un ion chargé positivement. Par conséquent, la La première énergie d'ionisation est inférieure à la deuxième énergie d'ionisation et la différence d'énergie entre la première et la deuxième énergie d'ionisation est significativement importante.
| Élément | Énergie de première ionisation (i1E) / /KJ Mol-1 | Deuxième énergie d'ionisation (i2E) / kj mol-1 |
| Hydrogène (H) | 1312 | |
| Helium (il) | 2372 | 5250 |
| Lithium (li) | 520 | 7292 |
| Béryllium (be) | 899 | 1757 |
| Bore (b) | 800 | 2426 |
| Carbone (c) | 1086 | 2352 |
| Azote (N) | 1402 | 2855 |
| Oxygène (O) | 1314 | 3388 |
| Fluor (f) | 680 | 3375 |
| Néon (NE) | 2080 | 3963 |
| Sodium (NA) | 496 | 4563 |
| Magnésium (mg) | 737 | 1450 |
Tendances de l'énergie d'ionisation dans le tableau périodique
Énergie de première ionisation (i1E): Les premières valeurs d'énergie d'ionisation des atomes à chaque période montrent la même variation. La magnitude est toujours inférieure aux valeurs d'énergie de la deuxième ionisation
Deuxième énergie d'ionisation (i2E): Les valeurs d'énergie d'ionisation des atomes de seconde à chaque période montrent la même variation; Ces valeurs sont toujours plus élevées que les premières valeurs d'énergie d'ionisation.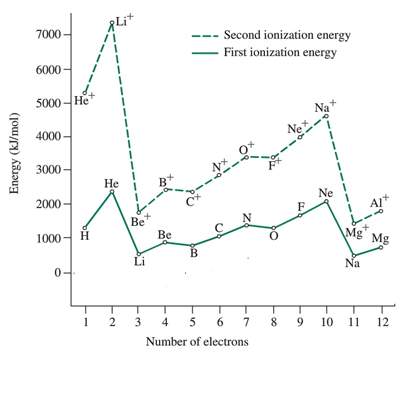 Image gracieuseté:
Image gracieuseté:


