Différence entre la solution saturée et sursaturée

Différence clé - Solution saturée vs sursaturée
Examinons d'abord brièvement le concept de saturation avant de passer à une analyse complexe de la différence entre la solution saturée et sursaturée. Les solutions sont faites en dissolvant un soluté dans un solvant. Les deux propriétés chimiques de la «saturation» et de la «sursaturation» dans les solvants dépendent principalement de la solubilité du soluté dans le solvant. À une température donnée, la solubilité d'un soluté dans un solvant particulier est une constante (Q).
Q est défini comme le produit ionique du soluté.
Exemple: Solubilité de l'agcl dans l'eau (qAGCL) = [Ag+] [Cl-]]
Généralement, si nous continuons à ajouter le soluté dans le solvant, il y a une quantité maximale que nous pouvons ajouter de dissolution dans le solvant. Après une certaine limite, le soluté commence à précipiter dans le solvant. Il devient une solution sursaturée après cette limite. Il est appelé une solution saturée lorsque nous pouvons dissoudre le soluté sans formation d'un précipité.
Le différence clé entre La saturation et la sursaturation sont que, La saturation est l'état auquel une solution d'une substance ne peut pas dissoudre plus de cette substance, et des quantités supplémentaires apparaîtront comme une phase distincte tandis que la sursaturation est un état d'une solution qui contient plus de matériau dissous que ce qui pourrait être dissous par le solvant dans des circonstances normales.
Qu'est-ce qu'une solution saturée?
Il y a un nombre très limité de composés qui sont infiniment solubles dans un solvant; ce qui signifie que nous pouvons mélanger le soluté dans le solvant dans n'importe quelle proportion pour se dissoudre sans former un précipité. Cependant, la plupart des solutés ne sont pas infiniment insolubles; Ils forment un précipité si vous ajoutez plus de soluté dans le solvant.
Les solutions saturées contiennent le nombre maximum de molécules de soluté qu'il peut dissoudre sans précipitation.
Qu'est-ce qu'une solution sursaturée?
Des solutions sursaturées sont formées si vous ajoutez un soluté supplémentaire à la solution saturée. En d'autres termes, c'est la condition dans une solution saturée, lorsque vous ajoutez une quantité supplémentaire de soluté dans la solution. Ensuite, il commencera à former un précipité dans la solution car le solvant a dépassé la quantité maximale de molécules de soluté qu'il peut dissoudre. Si vous augmentez la température du solvant, vous pouvez faire une solution saturée en dissolvant les molécules de soluté.

La sursaturation du sucre dans l'eau permet aux bonbons de roche de se former.
Quelle est la différence entre la solution saturée et sursaturée?
Définition de la solution saturée et sursaturée
Solution saturée: À une température particulière, une solution serait une solution saturée, si elle contient autant que les molécules de soluté que le solvant peut contenir.
Solution sursaturée: À une température particulière, une solution est une solution sursaturée si elle contient plus de molécules de soluté qu'il peut dissoudre.
Explication chimique
Pour solutions saturées; Q = Ksp (Pas de précipitations)
Pour solutions sursaturées; Q> ksp (Le précipité se formera)
Où;
Q = solubilité (quotient de réaction)
K sp= Produit de solubilité (Produit mathématique des concentrations d'ions dissous soulevées au pouvoir de leurs coefficients stoechiométriques)
Exemple: Envisagez de dissoudre le chlorure d'argent (AGCL) dans l'eau.
AGCL - Soluté et eau - solvant

L'AGCL a dissous dans l'eau Une grande quantité d'AgCl s'est dissoute dans l'eau.
La solution est claire que le précipité est clairement visible
Q = [AG+] [Cl-] = Ksp Q = [AG+] [Cl-]> Ksp
Où,
[AG+] = Concentration d'ag+ dans l'eau
[Cl-] = Concentration de Cl- dans l'eau
Pour Agcl, ksp = 1.8 × 10-dix mol2DM-6
Comment pouvons-nous faire des solutions saturées et sursaturées?
Des solutions saturées et sursaturées sont formées lorsque vous continuez à ajouter un soluté particulier dans un solvant. À une température donnée, d'abord, il forme une solution insaturée puis une solution saturée et enfin la solution sursaturée.
Exemple: Dissolution du sel dans l'eau
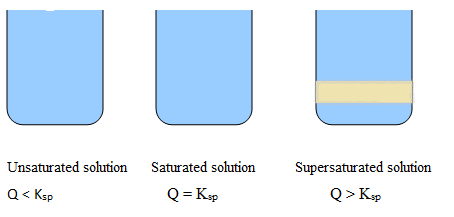 Solution insaturée: Moins de sel dans l'eau, solution claire, pas de précipitations.
Solution insaturée: Moins de sel dans l'eau, solution claire, pas de précipitations.
Solution saturée: La quantité maximale de sel est dissoute dans l'eau, la couleur de la solution change légèrement, mais aucune précipitation.
Solution sursaturée: Plus de sel est dissous dans l'eau, solution nuageuse, les précipitations sont visibles.
Image gracieuseté:
«Rock-Candy-Stticks» par Evan-Amos - propre travail. (CC BY-SA 3.0) via les communes


