Différence entre l'enthalpie d'atomisation et la dissociation des liaisons
Le différence clé entre l'enthalpie de l'atomisation et de la dissociation des liaisons L'enthalpie d'atomisation décrit l'énergie nécessaire pour séparer une molécule en ses atomes tandis que l'enthalpie de la dissociation des liaisons décrit la dissociation des liaisons chimiques dans une molécule.
Parfois, l'enthalpie de l'atomisation et l'enthalpie de la dissociation des liaisons sont les mêmes pour certains composés simples s'il y a des liaisons simples. En effet, dans des composés simples, la dissociation des liais.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'enthalpie de l'atomisation
3. Qu'est-ce que l'enthalpie de la dissociation des liaisons
4. Comparaison côte à côte - Enthalpie d'atomisation vs dissociation des liaisons sous forme tabulaire
5. Résumé
Qu'est-ce que l'enthalpie de l'atomisation?
L'enthalpie d'atomisation est le changement d'enthalpie qui se produit lors de la séparation complètement d'une substance chimique en ses atomes. Cette substance chimique peut être un élément chimique ou un composé chimique. Nous pouvons désigner ce changement d'enthalpie sous le nom de ΔHà. Pendant le processus d'atomisation, tous les types de liaisons chimiques sont décomposées et aucune n'est formée. Par conséquent, l'enthalpie de l'atomisation est toujours une valeur positive. La valeur d'enthalpie standard pour ce changement d'enthalpie est «l'enthalpie standard de l'atomisation». Les conditions standard considérées dans ce contexte sont les 268.15 K température et pression de 1 barre.
Par exemple, l'enthalpie d'atomisation pour la molécule d'eau fait référence à l'énergie nécessaire pour séparer les deux atomes d'hydrogène et l'atome d'oxygène dans la molécule d'eau. En d'autres termes, l'enthalpie de l'atomisation pour l'eau est la somme des énergies de dissociation des liaisons de deux liaisons O-H. De même, l'enthalpie de l'atomisation pour un solide élémentaire est l'enthalpie de la sublimation pour cette substance car la sublimation implique la conversion du solide en gaz monoatomique lors de l'évaporation.
Qu'est-ce que l'enthalpie de la dissociation des liaisons?
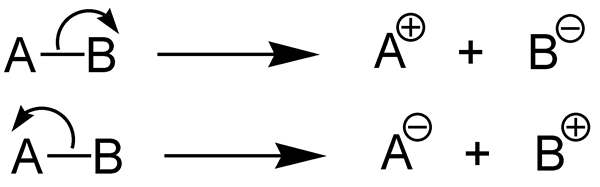
L'enthalpie de la dissociation des liaisons décrit le changement d'enthalpie qui se produit lors de la dissociation d'une liaison chimique. En d'autres termes, c'est la mesure de la force d'une liaison chimique. Par conséquent, nous pouvons dire que le changement d'enthalpie standard qui se produit lorsque la liaison chimique A-B se décompose par l'hémolyse et les fragments A et B est l'enthalpie de la dissociation des liaisons. Si la molécule que nous considérons est une molécule diatomique, alors l'enthalpie de dissociation des liaisons est égale à l'enthalpie de l'atomisation. Habituellement, les fragments A et B donnés par cette dissociation de liaison sont des espèces radicales. Nous pouvons désigner l'enthalpie de la dissociation des liaisons en tant que DH0.

Il existe différentes méthodes que nous pouvons utiliser pour mesurer la dissociation des liaisons telles que la détermination spectrométrique des niveaux d'énergie, la génération de radicaux par pyrolyse ou photolyse, mesures de la cinétique chimique et de l'équilibre, diverses méthodes calorimétriques et électrochimiques, etc.
Quelle est la différence entre l'enthalpie d'atomisation et la dissociation des liaisons?
La principale différence entre l'enthalpie d'atomisation et de dissociation des liaisons est que l'enthalpie d'atomisation décrit l'énergie nécessaire pour séparer une molécule en ses atomes tandis que l'enthalpie de dissociation des liaisons décrit la dissociation des liaisons chimiques dans une molécule. L'enthalpie de dissociation des liaisons et l'enthalpie de l'atomisation sont toujours des valeurs positives. Parfois, l'enthalpie de l'atomisation et l'enthalpie de la dissociation des liaisons sont les mêmes pour certains composés simples s'il y a des liaisons simples. Cependant, ces termes diffèrent les uns des autres la plupart du temps.
Ci-dessous les tables infographiques plus de différences entre l'enthalpie d'atomisation et la dissociation des liaisons.
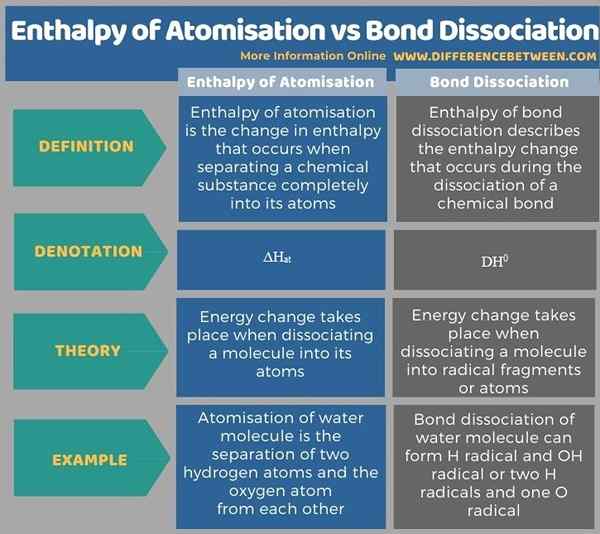
Résumé - Enthalpie de l'atomisation vs dissociation des liaisons
L'enthalpie d'atomisation et de dissociation des liaisons peut être utilisée de manière interchangeable pour certains composés simples, mais pas toujours ils sont équivalents. La principale différence entre l'enthalpie d'atomisation et de dissociation des liaisons est que l'enthalpie d'atomisation décrit l'énergie nécessaire pour séparer une molécule en ses atomes tandis que l'enthalpie de dissociation des liaisons décrit la dissociation des liaisons chimiques dans une molécule.
Référence:
1. «Enthalpie de l'atomisation.”Wikipedia, disponible ici.
Image gracieuseté:
1. «Hétérolyse (chimie)» par Jürgen Martens - Jürgen Martens (CC BY-SA 3.0) via Commons Wikimedia


