Différence entre la cystéine et la cystine
Le différence clé entre la cystéine et la cystine est que La cystéine est un acide aminé tandis que la cystine se forme lorsque deux acides aminés se réunissent via une liaison disulfure.
Un acide aminé est une molécule simple formée avec C, H, O, N et peut-être S. Il y a environ 20 acides aminés communs. Tous les acides aminés ont un -cooh, -nh2 des groupes et un -h se sont liés à un carbone. Le carbone est un carbone chiral et les acides alpha-aminés sont les plus importants dans le monde biologique. De plus, les acides aminés sont les éléments constitutifs des protéines. Lorsque deux acides aminés se joignent pour former un dipeptide, la combinaison se déroule dans un -nh2 groupe d'un acide aminé avec le groupe -cooh d'un autre acide aminé. Une molécule d'eau est retirée et la liaison formée est une «liaison peptidique».
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la cystéine
3. Qu'est-ce que la cystine
4. Comparaison côte à côte - cystéine vs cystine sous forme tabulaire
5. Résumé
Qu'est-ce que la cystéine?
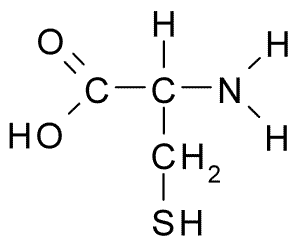
La cystéine est un acide alpha-amino. R groupe de cystéine est -ch2Sh, qui contient du soufre. La structure de la cystéine est donnée ci-dessous.

Figure 01: Structure de la molécule de cystéine
Nous pouvons l'abréger comme Cys. Le groupe thiol (-sh) de la cystéine rend le composé plus polaire. Par conséquent, cet acide aminé est soluble dans l'eau. De plus, le groupe thiol participe à une liaison hydrogène avec des molécules d'eau. Nous pouvons synthétiser la cystéine dans notre corps, donc c'est un acide aminé semi-essentiel. Cependant, il est parfois nécessaire d'obtenir de la cystéine à partir de sources alimentaires qui contiennent. Le poulet, les œufs, le lait, le yaourt, l'avoine et le brocoli sont quelques-unes des sources qui contiennent des niveaux élevés de cet acide aminé.
L'acide aminé de cystéine est important dans les systèmes biologiques car il s'agit d'un acide aminé commun que nous pouvons trouver dans les sites actifs des enzymes. Le groupe thiol est nucléophile; Par conséquent, ils participent à de nombreuses réactions enzymatiques. Les liaisons disulfures entre les groupes thiol sont cruciales pour le repliement des protéines et pour déterminer la structure tridimensionnelle des protéines.
Qu'est-ce que la cystine?
Lorsque deux résidus d'acides aminés de cystéine forment une liaison disulfure, le résidu dimérique résultant est connu sous le nom de cystine. Il est sous forme solide et est de couleur blanche. La structure de cette molécule est la suivante:
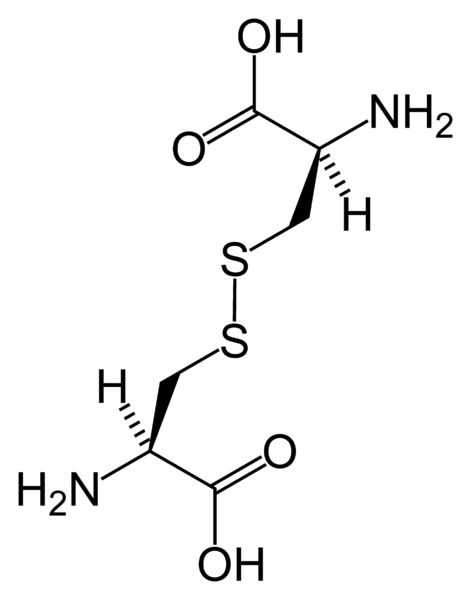
Figure 02: Structure de la cystine
De plus, nous pouvons trouver les résidus de cystine dans les protéines, et ils aident à maintenir la forme tridimensionnelle de la protéine.
Quelle est la différence entre la cystéine et la cystine?
Les deux termes cystéine et cystine sont souvent déroutants parce que les orthographes des deux termes et la prononciation sont similaires. Cependant, la principale différence entre la cystéine et la cystine est que la cystéine est un acide aminé, tandis qu'une cystine se forme lorsque deux acides aminés se réunissent via une liaison disulfure. Lorsque l'on considère l'importance de ces deux composés, la cystéine est importante pour la synthèse des protéines, la détoxification et de nombreuses autres fonctions métaboliques tandis que la cystine est importante pour maintenir la structure tertiaire d'une protéine. Donc, c'est aussi une différence significative entre la cystéine et la cystine.

Résumé - Cystéine vs cystéine
La cystéine et la cystine sont des composantes biologiques importantes dans notre corps. En résumé, la principale différence entre la cystéine et la cystine est que la cystéine est un acide aminé, tandis qu'une cystine se forme lorsque deux acides aminés se réunissent via une liaison disulfure.
Référence:
1. «Cystéine." Centre national d'information sur la biotechnologie. Base de données de composés PubChem, U.S. Bibliothèque nationale de médecine, disponible ici.
Image gracieuseté:
1. «Cystine-squelettique» de Benjah-BMM27 supposée (basée sur les réclamations du droit d'auteur). - Aucune source lisible par machine fournie. Propre travail assumé (basé sur les réclamations du droit d'auteur) (domaine public) via Commons Wikimedia
2. «Gordo Cysteine» par Bigblue0092 (CC par 2.0) via Flickr