Différence entre les complexes carbonyle et nitrosyle
Le Différence clé entre les complexes carbonyle et nitrosyle Est-ce que les complexes carbonyle contiennent des ligands -co, tandis que les complexes nitrosyles contiennent -Un ligands.
Les complexes de coordination sont des complexes inorganiques contenant un atome central ou un ion (généralement un ion métallique) et des molécules environnantes nommées ligands qui sont liés à l'atome ou à l'ion central. L'atome central ou l'ion est généralement connu sous le nom de centre de coordination.
CONTENU
1. Aperçu et différence clé
2. Que sont les complexes carbonyle
3. Quels sont les complexes nitrosyles
4. Carbonyle vs complexes nitrosyles sous forme tabulaire
5. Résumé - Complexes carbonyle vs nitrosyle
Que sont les complexes carbonyle?
Les complexes carbonyle sont des complexes de coordonnées composés d'un centre métallique et de ligands carbonyle. Les ligands carbonyle que nous pouvons trouver principalement dans ces complexes sont des ligands -co. Nous pouvons fréquemment utiliser des ligands carbonyle comme matériaux de départ pour d'autres composés de coordination également parce que les ligands -co n'ont pas de charge, et le CO est une substance gazeuse. Cela permet de faire facilement une substitution de ligand facilement en purgeant le CO hors du récipient de réaction.
Lorsque vous envisagez la liaison des ligands -co à un centre métal. Ici, le CO Ligand agit comme un ligand terminal car il n'a qu'une seule liaison chimique d'un côté. La liaison du ligand CO se produit à travers l'atome de carbone de la molécule de CO. De plus, le partage de cette paire d'électrons solitaires peut se produire entre un, deux ou même trois centres métalliques. Ici, ces centres métalliques doivent être interconnectés avec des liaisons métalliques. Lorsque plus d'un centre métallique est impliqué dans la formation de complexes carbonyle, le ligand -co agit comme un ligand ponté. De plus, si les deux métaux qui se trouvent dans la liaison métal-métal sont différents les uns des autres, cela signifie qu'un métal peut fortement attirer le ligand CO que l'autre métal selon l'électronégativité. Dans ce type de situation, le CO Ligand agit comme un ligand semi-ponctuel.
De plus, le ligand -co dans des complexes carbonyle peut également se produire dans le type donneur Pi-Electron. Ici, les électrons Pi de la molécule de CO sont impliqués dans le don d'électrons aux orbitales métalliques. Mais ces complexes peuvent utiliser ces électrons en conjugaison avec la paire d'électrons des atomes de carbone du ligand CO. En effet.
Exemples de complexes carbonyle
Quelques exemples pour les complexes carbonyle sont:
- [Coco)6]]3+
- [Fe (CO)6]]2+
- [Rh (CO)6]]3+
- [MN (CO)6]]+
- [V (CO)6]]-
Quels sont les complexes nitrosyles?
Les complexes nitrosyles sont des complexes de coordonnées composés d'un centre métallique et de ligands d'oxyde nitrique. La formule chimique de ce ligand est -NO, qui est liée à un centre de métal de transition. Surtout, ce ligand se produit comme le cation nitrosyle: non+. Ce cation est isoélectronique avec du ligand co. Par conséquent, la liaison entre un métal et le NO et la liaison entre le métal et le ligand CO ont les mêmes propriétés.
Le non ligand agit comme un donneur à deux électrons où il partage la paire d'électrons solitaires avec le centre métallique. De plus, il peut accepter les électrons du métal par le processus de liaison arrière. Cependant, dans le contexte de la comptabilité électronique, deux ligands linéaires sont chimiquement équivalents à trois ligands linéaires.

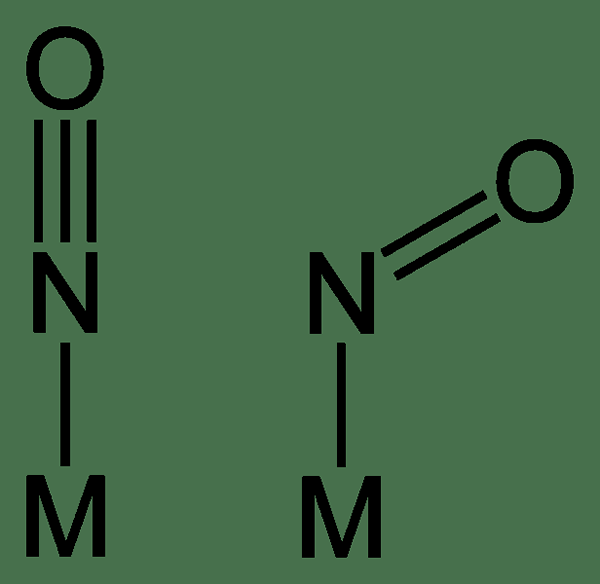
Figure 01: ligands nitrosyles linéaires et pliés
De plus, il peut y avoir des ligands nitrosyles linéaires ou pliés. Le ligand linéaire a trois liaisons covalentes entre les atomes N et O, tandis que le ligand plié a deux liaisons covalentes entre les atomes N et O. Généralement, le ligand NO forme une liaison linéaire entre le centre de métal de transition et le ligand, tandis que les ligands pliés se produisent lorsque le processus de liaison arrière est moins important.
Quelle est la différence entre les complexes carbonyle et nitrosyle?
Le complexe carbonyle et le complexe nitrosyle sont deux types de complexes de coordination contenant un centre métallique de transition et des ligands entourant le centre métallique. La principale différence entre les complexes carbonyle et nitrosyle est que les complexes carbonyle contiennent des ligands -co, tandis que les complexes nitrosyle contiennent -Un ligands.
L'infographie ci-dessous répertorie les différences entre les complexes carbonyle et nitrosyle sous forme tabulaire.
Résumé - Complexes carbonyle vs nitrosyle
Les complexes carbonyle sont des complexes de coordonnées composés d'un centre métallique et de ligands carbonyle. Les complexes nitrosyles sont des complexes de coordonnées composés d'un centre métallique et de ligands d'oxyde nitrique. Par conséquent, la principale différence entre les complexes carbonyle et nitrosyle est que les complexes carbonyle contiennent des ligands -co, tandis que les complexes nitrosyle contiennent -Un ligands.
Référence:
1. "dix.2: Principes des complexes carbonyle". Chemistry LibreTexts.
Image gracieuseté:
1. «Metal-nitrosyl-coordination-modes-2d» (domaine public) via Commons Wikimedia


