Différence entre les alcènes et les alcynes
Le différence clé entre les alcènes et les alcynes est que le Les alcènes ont des liaisons doubles en carbone-carbone tandis que les alcynes ont des liaisons triples en carbone-carbone.
Les alcènes et les alcynes sont des hydrocarbures ayant des atomes de carbone et d'hydrogène. Il peut y avoir d'autres substituants attachés à ces molécules au lieu d'hydrogènes. Par conséquent, un grand nombre de molécules sont possibles. En raison de plusieurs liaisons, ils peuvent polymériser et faire des chaînes plus grandes. Ainsi, ils sont particulièrement précieux dans la synthèse utile des polymères. Par exemple, PVC, caoutchouc, différents types de plastique, etc.
CONTENU
1. Aperçu et différence clé
2. Que sont les alcènes
3. Que sont les alcynes
4. Comparaison côte à côte - alcènes vs alcynes sous forme tabulaire
5. Résumé
Que sont les alcènes?
Les alcènes sont des hydrocarbures avec des doubles liaisons en carbone-carbone. Nous les appelons également comme des oléfines. L'éthène est la molécule d'alcène la plus simple, ayant deux carbones et quatre hydrogènes. Il a une double liaison carbone-carbone, et la formule moléculaire est C2H4. La structure chimique de cette molécule est la suivante:
H2C = Ch2
Lorsque nous nommons les alcènes, nous utilisons le suffixe «ene» au lieu de «ane» à la fin du nom d'un alcane. Nous devons prendre la chaîne de carbone la plus longue contenant la double liaison et devons la compter en quelque sorte, pour donner le nombre minimum à la double liaison. Les propriétés physiques des alcènes sont similaires aux alcanes correspondants.
Nature
Habituellement, les alcènes ayant des poids moléculaires faibles sont sous forme gazeuse à température ambiante. Par exemple, l'éthane et le propène sont des gaz. Les alcènes sont des molécules relativement non polaires; Par conséquent, ils se dissolvent dans des solvants ou des solvants non polaires avec une très faible polarité. Par conséquent, les alcènes sont légèrement solubles dans l'eau. De plus, la densité des alcènes est inférieure à celle de l'eau.
Ces composés subissent des réactions d'addition en raison des doubles liaisons. Par exemple, dans la réaction d'hydrogénation, deux hydrogènes attachés à la double liaison et faisant l'alcène à l'alcane correspondant. Cette réaction accélère en présence d'un catalyseur métallique. Dans une réaction d'addition comme celle-ci, si le réactif qui va se fixer à la double liaison s'attache au même côté de la molécule, nous l'appelons un ajout syn. Si l'ajout est sur les côtés opposés, alors nous l'appelons un anti-ajout.
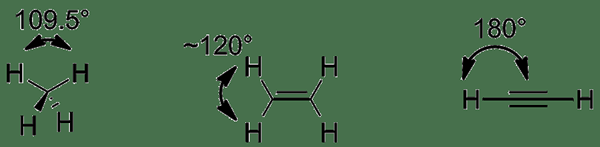
Figure 01: Comparaison des alcanes, des alcènes et des alcynes
De même, les alcènes subissent différents types d'ajouts avec des molécules comme les halogènes, le HCl, l'eau, etc. Les ajouts peuvent avoir lieu en tant que type markonikov ou anti-markonikov. De plus, nous pouvons faire ces molécules via des réactions d'élimination. Lorsque l'on considère la stabilité des alcènes, plus les atomes de carbone de la double liaison sont fortement substitués, plus la stabilité est grande. De plus, les alcènes peuvent avoir des diastéréoisomères; Par conséquent, peut montrer le stéréoisomérisme.
Que sont les alcynes?
Les molécules d'hydrocarbures à triple liaison carbone-carbone sont des alcynes. Le nom commun de cette famille est les acétylènes. L'éthylène est la molécule la plus simple de cette famille avec deux carbones et deux hydrogènes. Il a la formule moléculaire de C2H2 Et ce qui suit est sa structure.
H - c ≡ C - H
Nous pouvons nommer ces composés de la même manière que les alcènes. Autrement dit, nous pouvons les nommer en remplaçant «Ane» par «yne» à la fin du nom de l'alcane correspondant. Là, nous devons compter la chaîne de carbones pour donner aux atomes de carbone de la triple liaison le nombre le plus bas possible.

Figure 02: Exemples d'alcynes
De plus, les propriétés physiques des alcynes sont similaires aux alcanes correspondants. Habituellement, les alcynes ayant des poids moléculaires faibles sont sous forme gazeuse à température ambiante. Par exemple, Ethyne est un gaz. De plus, ces composés sont des molécules relativement non polaires; Par conséquent, ils se dissolvent dans des solvants ou des solvants non polaires avec une très faible polarité. Par conséquent, ils sont légèrement solubles dans l'eau. La densité d'Alkynes est inférieure à celle de l'eau. Les alcynes subissent des réactions d'addition, en raison de sa triple liaison. De plus, nous pouvons les synthétiser par des réactions d'élimination.
Quelle est la différence entre les alcènes et les alcynes?
Les alcènes et les alcynes sont des hydrocarbures insaturés. La principale différence entre les alcènes et les alcynes est que les alcènes ont des liaisons doubles carbone-carbone tandis que les alcynes ont des liaisons triples carbone-carbone. De plus, les carbones à double liaison sont SP2 hybridé dans les alcènes et les carbones triples liaisons sont hybridés en alcynes. Une autre différence entre les alcènes et les alcynes est que les alcènes n'ont pas d'hydrogène acide tandis que les alcynes ont des atomes d'hydrogène acides.
L'infographie ci-dessous est une représentation tabulaire de la différence entre les alcènes et les alcynes.
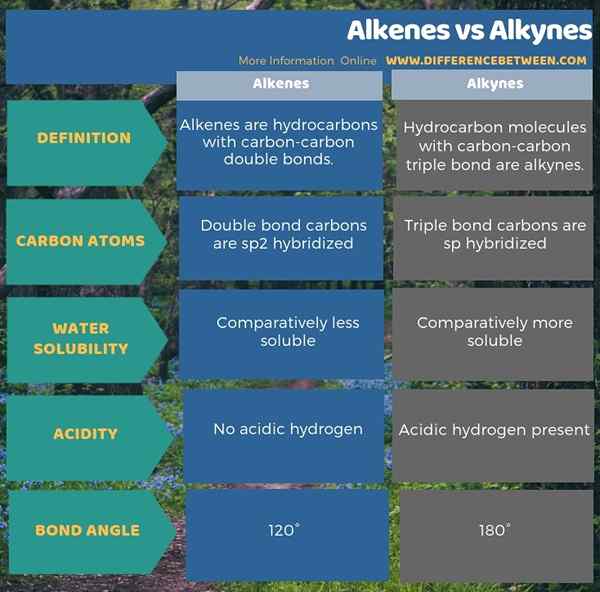
Résumé - Alcènes vs Alkynes
Les alcènes et les alcynes sont un composé d'hydrocarbure contenant des atomes d'hydrogène. De plus, ce sont des composés insaturés (ont des liaisons doubles ou triples). La principale différence entre les alcènes et les alcynes est que les alcènes ont des liaisons doubles carbone-carbone tandis que les alcynes ont des liaisons triples carbone-carbone.
Référence:
1. LibreTexts. «Nomenclature des alcènes.”Chemistry LibreTexts, National Science Foundation, 26 novembre. 2018. Disponible ici
2. «Alcène.»Wikipedia, Wikimedia Foundation, 28 novembre. 2018. Disponible ici
Image gracieuseté:
1.«Angles d'alcane alcène alcyne» par b levin13 - propre travail, (cc by-sa 3.0) via Commons Wikimedia
2.«Iupac-alkyne» par fvasconcellos (CC By-Sa 3.0) via Commons Wikimedia


