Quelle est la différence entre l'allostérisme positif et négatif
Le Différence clé entre l'allostérisme positif et négatif Est-ce que l'alostérisme positif dans les protéines montre une affinité élevée pour les ligands, tandis que l'alostérisme négatif dans les protéines montre une faible affinité pour les ligands.
L'alostérisme ou le comportement allostérique est le phénomène dans lequel l'activité d'une protéine peut être modifiée en fonction de la liaison de certaines molécules à un site autre que le site actif de la protéine (spécifiquement dans les enzymes). Une alsostérisme positif indique que la liaison d'une molécule effectrice à une enzyme entraîne la transformation de l'enzyme. En revanche, un allostéirsm négatif indique qu'une liaison à la molécule effectrice entraîne que l'enzyme change sa configuration d'une forme active à une forme inactive.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'allostérisme positif
3. Qu'est-ce que l'allostérisme négatif
4. Allostérisme positif vs négatif sous forme tabulaire
5. Résumé - Allostérisme positif vs négatif
Qu'est-ce que l'allostérisme positif?
L'alostérisme positif est le changement dans la configuration d'une protéine (principalement une enzyme) d'une forme inactive à une forme active lors de la liaison d'une molécule effectrice. La molécule effectrice se lie à un site autre que le site actif de l'enzyme; il s'appelle le site allostérique. Ce processus est également connu sous le nom activation allostérique.
Un exemple courant pour une telle liaison à la molécule effectrice est la liaison de la molécule d'oxygène avec une molécule d'hémoglobine, qui active la molécule d'hémoglobine pour transporter efficacement l'oxygène vers les cellules. Là, la molécule d'oxygène se lie avec le fer ferreux d'une molécule d'hème dans la molécule d'hémoglobine. La forme active est connue sous le nom d'oxy-hémoglobine, tandis que la forme inactive est connue sous le nom de désoxy-hémoglobine.
Qu'est-ce que l'allostérisme négatif?
L'alostérisme négatif est le changement dans la configuration d'une enzyme d'une forme active à une forme inactive lors de la liaison d'une molécule effectrice. La molécule effectrice se lie à un site autre que le site actif de l'enzyme; il s'appelle le site allostérique. Ce processus est également connu sous le nom inhibition allostérique.

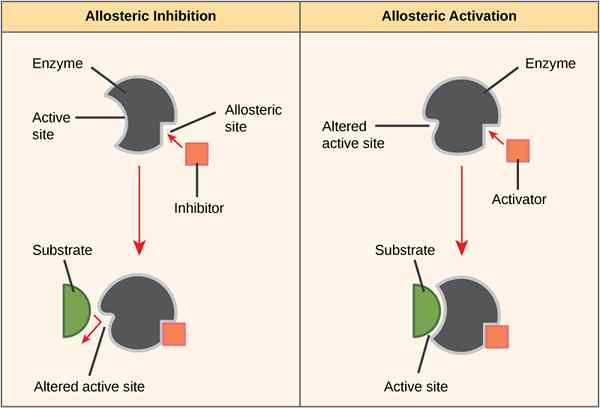
Figure 01: Allostérisme positif et négatif
Pendant l'alostérisme négatif, la liaison d'un ligand diminue l'affinité de l'enzyme pour le substrat sur les autres sites actifs disponibles pour la liaison du substrat. Un exemple est la liaison de 2,3-bpg à un site allostérique sur l'hémoglobine, ce qui entraîne une diminution de l'affinité pour l'oxygène de toutes les sous-unités.
Quelle est la différence entre l'allostérisme positif et négatif?
Dans une altération positive, la liaison d'une molécule effectrice à une enzyme entraîne la modification de l'enzyme de la configuration en une forme active, tandis que dans un allostéirsm négatif, la liaison d'une molécule d'effecteur fait que l'enzyme modifie sa configuration de la forme active à la forme inactive. La principale différence entre l'allostérisme positif et négatif est que l'alostérisme positif dans les protéines montre une affinité élevée pour les ligands, tandis que l'alostérisme négatif dans les protéines montre une faible affinité pour les ligands. De plus, l'alostérisme positif implique l'activation, tandis que les allosteirsm négatifs impliquent une inhibition. La liaison de l'oxygène avec l'hémoglobine est un exemple de tout alostérisme positif tandis que la liaison de 2,3-bpg avec l'hémoglobine est un exemple de allostérisme négatif.
L'infographie suivante présente la différence entre l'alostérisme positif et négatif sous forme tabulaire pour une comparaison côte à côte.
Résumé - Allostérisme positif vs négatif
Dans l'alostérisme ou le comportement allostérique, l'activité d'une protéine peut être modifiée en fonction de la liaison de certaines molécules à un site autre que le site actif de la protéine (spécifiquement dans les enzymes). La principale différence entre l'allostérisme positif et négatif est que l'alostérisme positif dans les protéines montre une affinité élevée pour les ligands, tandis que l'alostérisme négatif dans les protéines montre une faible affinité pour les ligands.
Référence:
1. «3.6: Interactions allostériques." Chemistry LibreTexts, LibreTexts, 17 juillet 2020.
Image gracieuseté:
2. «Figure 06 05 05 - Activation et inhibition allostérique» par CNX OpenStax - (CC par 4.0) via Commons Wikimedia


