Quelle est la différence entre la cellule de mercure et la cellule de diaphragme
Le différence clé entre la cellule de mercure et la cellule de diaphragme Est-ce qu'une cellule de mercure a généralement besoin d'une tension plus élevée et plus d'énergie par rapport à une cellule de diaphragme.
Nous pouvons utiliser les cellules de mercure, les cellules de diaphragme et les cellules membranaires pour produire du chlore et de la soude caustique à une échelle industrielle. Dans toutes les méthodes, la base consiste à électrolyser la solution de chlorure de sodium.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une cellule de mercure
3. Qu'est-ce qu'une cellule de diaphragme
4. Cellule de mercure vs cellule de diaphragme sous forme tabulaire
5. Résumé - Cellule de mercure vs cellule de diaphragme
Qu'est-ce qu'une cellule de mercure?
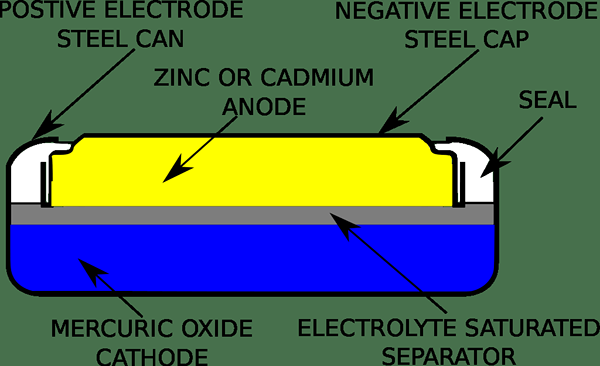
Une batterie à la cellule de mercure ou au mercure est une batterie électrochimique non recessable. Nous pouvons le classer comme une cellule principale et est également connu sous le nom batterie d'oxyde mercurique, Cellule bouton, et Ruben-Mallory. En règle générale, une batterie de mercure utilise une réaction entre l'oxyde mercurique et les électrodes de zinc dans un électrolyte alcalin. La tension de la cellule de mercure est 1.35 volts lorsque la décharge de la cellule reste pratiquement constante. Ici, la capacité est beaucoup plus grande que la batterie en zinc-carbone de la même taille. Même dans le passé, ces batteries ont été utilisées comme cellules boutonnées pour les montres, les aides auditives, les caméras et les calculatrices.

La cathode de la cellule de mercure est généralement soit de l'oxyde de mercure pur (ii), soit un mélange d'oxyde de mercure (ii) avec du dioxyde de manganèse. Cependant, l'oxyde mercurique est un non-conducteur. Par conséquent, nous devons mélanger le graphite avec lui pour empêcher la collecte de mercure en grandes gouttelettes. De plus, l'anode de cette cellule est essentiellement en zinc, et elle se sépare de la cathode via une couche de papier d'un matériau poreux trempé avec de l'électrolyte. Nous appelons cela un pont de sel. De plus, l'électrolyte de la cellule de mercure est soit de l'hydroxyde de sodium ou de l'hydroxyde de potassium.
Lorsque l'on considère les caractéristiques électriques d'une cellule de mercure, si la cathode est l'oxyde mercurique, ces cellules ont une courbe de décharge très plate qui peut maintenir la tension à 1.35 V jusqu'aux 5% de la vie de la cellule. De plus, la tension reste à moins de 1% pendant plusieurs années à une charge légère. D'un autre côté, les cellules de mercure avec l'oxyde mercurique et la cathode de dioxyde de manganèse ont 1.Sortie 4 V et une courbe de décharge plus en pente.
Qu'est-ce qu'une cellule de diaphragme?
Une cellule de diaphragme est une cellule électrolytique utile pour produire de l'hydroxyde de sodium et du chlore à partir de saumure de chlorure de sodium. Une cellule de diaphragme implique l'écoulement de la solution de saumure (qui est introduite dans l'anode) de la zone de l'anode à la zone de la cathode via le diaphragme perméable. Dans ce processus, la zone d'anode est séparée de la zone de la cathode via un diaphragme perméable. Cependant, la cellule de diaphragme présente moins d'efficacité énergétique, une faible convivialité environnementale et une faible pureté du produit. Par rapport à cette cellule, la cellule membranaire est un processus optimisé.
Généralement, une cellule de diaphragme est fabriquée à partir d'un mélange poreux d'amiante et de polymères. La solution à l'intérieur de la cellule peut s'infiltrer à travers ce matériau du compartiment anode au compartiment cathode. Nous pouvons utiliser cette cellule pour obtenir du chlore de l'électrolyzage de la solution de chlorure de sodium. L'anode est généralement en titane et la cathode est en acier. Le chlore provient de l'anode, tandis que l'hydrogène provient de la cathode. De plus, la solution sortant de la cathode est une solution d'hydroxyde de sodium contaminé par du chlorure de sodium. Afin de s'assurer que le débit liquide ne se produit que de l'anode à la cathode, le compartiment anode a toujours plus de liquide.
Quelle est la différence entre la cellule de mercure et la cellule de diaphragme?
La cellule de mercure et la cellule de diaphragme sont deux des trois cellules principales que nous pouvons utiliser pour fabriquer du chlore ainsi que du soda caustique. La principale différence entre la cellule de mercure et la cellule de diaphragme est qu'une cellule de mercure a généralement besoin d'une tension plus élevée et plus d'énergie par rapport à une cellule de diaphragme. Une cellule de mercure a généralement une anode de zinc et une cathode en oxyde de mercure pur (ii) ou un mélange d'oxyde de mercure (ii) avec du dioxyde de manganèse. Une cellule de diaphragme, en revanche, a une anode en titane et une cathode en acier.
L'infographie ci-dessous présente les différences entre la cellule de mercure et la cellule de diaphragme sous forme tabulaire pour une comparaison côte à côte.
Résumé - Cellule de mercure vs cellule de diaphragme
Les cellules de mercure et les cellules de diaphragme sont deux cellules que nous pouvons utiliser pour fabriquer du chlore et de la soude caustique. La principale différence entre la cellule de mercure et la cellule de diaphragme est qu'une cellule de mercure a généralement besoin d'une tension plus élevée et plus d'énergie par rapport à une cellule de diaphragme.
Référence:
1. «Cellule du diaphragme et cellule membranaire." Les cellules de diaphragme et de membrane pour la fabrication de chlore. Guide de chimie.
Image gracieuseté:
1. «Mercury Battery2» par SVG Dérivé par Rehua, original de la bibliothèque et du centre d'information du Ted Ankara College - English Wikipedia (utilisation gratuite protégé par le droit d'auteur) via Commons Wikimedia


