Quelle est la différence entre les espèces isotoniques et isoélectroniques
Le Différence clé entre les espèces isotoniques et isoélectroniques est que les espèces isotoniques ont un nombre similaire de neutrons, tandis que les espèces isoélectroniques ont un nombre similaire d'électrons.
Les termes isotoniques et isoélectroniques se réfèrent à des espèces chimiques ayant quelque chose en commun, e.g., même nombre d'électrons, même nombre de neutrons, etc.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les espèces isotoniques
3. Quelles sont les espèces isoélectroniques
4. Espèces isotoniques vs isoélectroniques sous forme tabulaire
5. Résumé - Espèce isotoniques vs isoélectroniques
Quelles sont les espèces isotoniques?
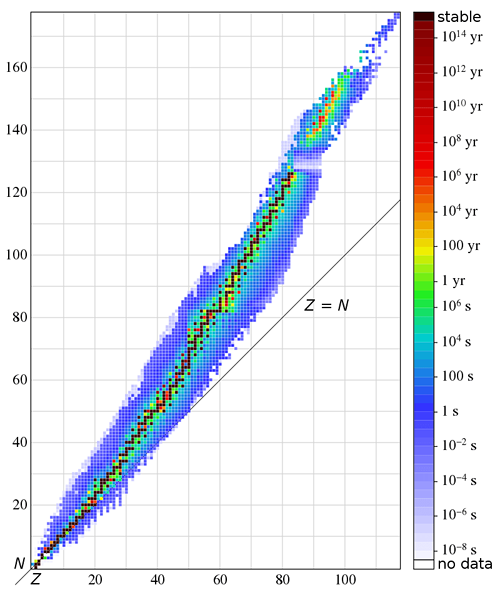
Les espèces isotoniques sont des espèces chimiques ayant un nombre identique de neutrons. Ceux-ci sont également connus sous le nom isotones. Les isotones sont deux ou plusieurs nucléides avec le même nombre de neutrons, mais ils ont un nombre différent de protons. Le numéro de neutrons est indiqué par n, et le numéro de proton est indiqué par z.
Un exemple courant serait le bore -12 et le carbone - 13 noyaux. Bothes ces nucléides contiennent 7 neutrons dans chaque atome. Par conséquent, nous pouvons les nommer comme des isotones. Un groupe similaire d'espèces isotoniques comprend des atomes avec 20 neutrons par atome. Ce groupe comprend S-36, CL-37, AR-38, K-39 et CA-40. Tous ces atomes ont 20 neutrons mais un nombre différent de protons. Nous pouvons obtenir le nombre de protons en déduisant 20 à partir du numéro de masse. E.g., Pour l'atome de soufre, le nombre de protons par atome = 36 - 20 = 16.

Le terme isotonique vient du grec signifiant «même étirement."Il a été introduit par le physicien allemand K.Guggenheimer. Il peut y avoir de nombreux atomes avec le même nombre de neutrons lorsque l'on considère les isotopes des éléments chimiques. En règle générale, le plus grand nombre de nucléides observationnellement stables sort pour deux espèces isotoniques 50 et 82.
Quelles sont les espèces isoélectroniques?
Les espèces isoélectroniques sont des espèces chimiques ayant un nombre identique d'électrons. En d'autres termes, les espèces isoélectroniques ont le même nombre d'électrons ou la même structure électronique. Ce phénomène est connu sous le nom d'isoélectronique.
Par exemple, le monoxyde de carbone, le NO + et le N2 sont des espèces chimiques isoélectroniques car ces structures ont le même nombre d'électrons par composé. En revanche, CH3COOH et CH3N = NCH3 ne sont pas isoélectroniques car ils ont un nombre différent d'électrons.

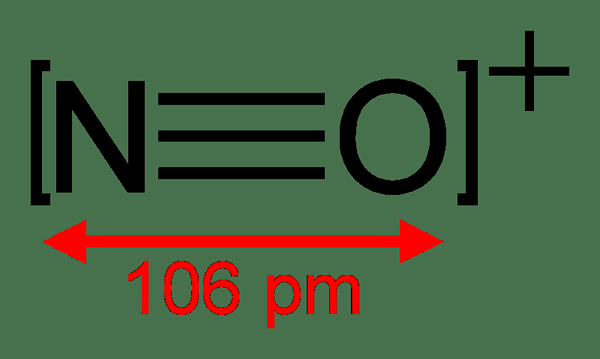
L'importance d'identifier les espèces chimiques isoélectroniques est la capacité d'étudier des espèces significativement liées comme des paires ou des séries. De plus, nous pouvons nous attendre à ce que cela soit utile dans la cohérence et la prévisibilité des propriétés de ces espèces chimiques. Par conséquent, il nous fournit des indices sur les propriétés et réactions possibles.
Par exemple, l'atome n et l'ion o + sont isoélectroniques les uns avec les autres. C'est parce que ces deux espèces ont cinq électrons de valence et le [il] 2S22P3. Un autre exemple courant est la série de cations avec K +, Ca2 + et Sc3+. De même, Cl-, S2- et P3- est une série d'anions avec un nombre similaire d'électrons.
Dans les molécules diatomiques, nous pouvons utiliser des diagrammes orbitaux moléculaires pour illustrer l'isoélectronicité dans une molécule diatomique. Cela montre des orbitales atomiques qui se mélangent en espèces isoélectroniques, indiquant la combinaison orbitale identique ainsi que la liaison.
Il existe des composés polyatomiques qui peuvent être isoélectroniques les uns avec les autres. Un exemple communément connu serait la série d'acides aminés avec sérine, cystéine et sélénocystéine. Ces acides aminés sont différents les uns des autres en fonction du chalcogène spécifique qui est présent dans un emplacement dans la chaîne latérale.
Quelle est la différence entre les espèces isotoniques et isoélectroniques?
Les espèces chimiques isotoniques et isoélectroniques sont importantes pour étudier les propriétés chimiques des composés apparentés. La principale différence entre les espèces isotoniques et isoélectroniques est que chez les espèces isotoniques, le nombre de neutrons est le même, tandis que, chez les espèces isoélectroniques, le nombre d'électrons est le même.
L'infographie ci-dessous présente les différences entre les espèces isotoniques et isoélectroniques sous forme tabulaire pour une comparaison côte à côte.
Résumé - Espèce isotoniques vs isoélectroniques
Les espèces isotoniques sont des espèces chimiques ayant un nombre identique de neutrons. Les espèces isoélectroniques sont des espèces chimiques ayant un nombre identique d'électrons. Par conséquent, la principale différence entre les espèces isotoniques et isoélectroniques est que les espèces isotoniques ont un nombre similaire de neutrons, tandis que les espèces isoélectroniques ont un nombre similaire d'électrons.
Référence:
1. «Laquelle des espèces suivantes est isotonique avec 37 RB 86 ?" Tardigrade, 30 octobre. 2019.
Image gracieuseté:
1. «Isotopes et demi-vie» par Benrg - propre travail (domaine public) via Commons Wikimedia
2. «Carbon Monoxyde Simple» par Yikrazuul (Talk) - Propre travaux (domaine public) via Commons Wikimedia
3. «Nitrosonium-2d-dimensions» (domaine public) via Commons Wikimedia


