Quelle est la différence entre le processus adiabatique adiabatique et réversible
Le Différence clé entre le processus adiabatique et réversible adiabatique est que dans les processus adiabatiques, le système adiabatique est isolé et n'autorise aucun transfert de chaleur, tandis que le processus adiabatique réversible implique un transfert de chaleur dans lequel la quantité de chaleur transférée est directement proportionnelle au changement d'entropie du système.
Les processus adiabatiques sont des processus thermodynamiques dans lesquels aucun transfert de chaleur net ne se produit en raison de conditions de réaction. Le processus adiabatique réversible n'implique pas non plus de transfert de chaleur. Ici, la chaleur transférée est directement proportionnelle au changement d'entropie du système, et le changement d'entropie est zéro, ce qui rend le transfert de chaleur zéro.
CONTENU
1. Aperçu et différence clé
2. Quel est le processus adiabatique
3. Qu'est-ce que le processus adiabatique réversible (processus isentropique)
4. Processus adiabatique vs adiabatique réversible sous forme tabulaire
5. Résumé - Processus adiabatique adiabatique vs réversible
Quel est le processus adiabatique?
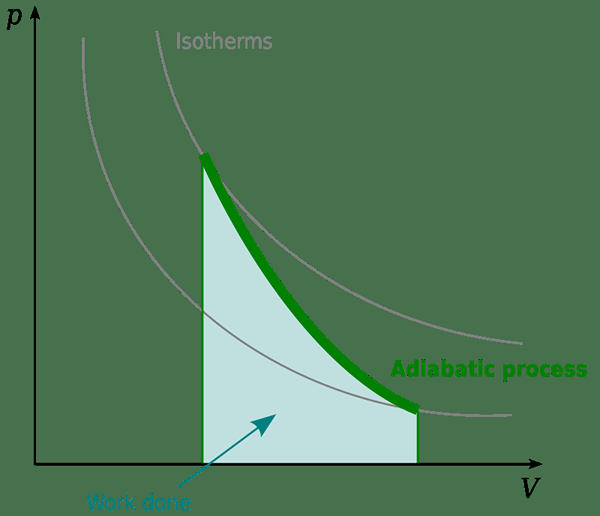
Le processus adiabatique peut être défini comme un changement de système dans lequel aucune chaleur n'est transférée dans ou hors du système. Principalement, le transfert de chaleur est arrêté de deux manières. Une méthode consiste à utiliser une limite thermiquement isolée afin qu'aucune chaleur ne puisse entrer ou sortir. Par exemple, une réaction qui se produit dans un flacon dewar est adiabatique. Une autre méthode qu'un processus adiabatique peut avoir lieu est lorsqu'un processus a lieu très rapidement; Ainsi, il ne reste plus de temps pour transférer de la chaleur à l'intérieur et à l'extérieur.

Dans la thermodynamique, nous montrons les changements adiabatiques de dq = 0. Dans ces cas, il existe une relation entre la pression et la température. Par conséquent, le système subit des modifications dues à la pression dans les conditions adiabatiques. C'est ce qui se passe dans la formation des nuages et les courants de convection à grande échelle. À des altitudes plus élevées, il y a une pression atmosphérique plus faible. Lorsque l'air se réchauffe, il a tendance à monter. Parce que la pression atmosphérique extérieure est faible, la parcelle d'air augmentant tentera de se développer. Lors de l'expansion, les molécules d'air fonctionnent, et cela affectera leur température. C'est pourquoi la température réduit lorsque vous montez.
Selon la thermodynamique, l'énergie dans le colis reste constante, mais elle peut être convertie pour faire le travail d'extension ou pour maintenir sa température. Il n'y a pas d'échange de chaleur avec l'extérieur. Ce même phénomène s'applique également à la compression de l'air (e.g., un piston). Dans cette situation, lorsque le colis d'air se comprime, la température augmente. Ces processus sont appelés chauffage et refroidissement adiabatiques.
Qu'est-ce que le processus adiabatique réversible (processus isentropique)?
Un processus adiabatique réversible est également connu comme un processus isentropique. Les processus spontanés augmentent l'entropie de l'univers. Lorsque cela se produit, l'entropie du système ou l'entropie environnante peut augmenter. Un processus isentropique se produit lorsque l'entropie du système reste constante. Un processus adiabatique réversible est un exemple de processus isentropique. De plus, les paramètres constants dans un processus isentropique sont l'entropie, l'équilibre et l'énergie thermique.
Ces types de processus sont des processus thermodynamiques idéalisés qui sont adiabatiques, mais le transfert de chaleur est sans friction, ce qui signifie qu'il n'y a pas de transfert de chaleur ou de matière, et le processus est réversible.
Quelle est la différence entre le processus adiabatique adiabatique et réversible?
Le processus adiabatique peut être défini comme un changement d'un système dans lequel aucune chaleur n'est transférée dans ou hors du système. Un processus adiabatique réversible est également connu comme un processus isentropique. La principale différence entre le processus adiabatique et réversible adiabatique est que dans les processus adiabatiques, le système adiabatique est isolé et ne permet aucun transfer du système.
L'infographie ci-dessous présente les différences entre le processus adiabatique adiabatique et réversible sous forme tabulaire pour une comparaison côte à côte.
Résumé - Processus adiabatique adiabatique vs réversible
Les processus adiabatiques sont des processus thermodynamiques dans lesquels aucun transfert de chaleur net ne se produit en raison des conditions de réaction. La principale différence entre le processus adiabatique et réversible adiabatique est que dans les processus adiabatiques, le système adiabatique est isolé et n'autorise aucun transfer le système.
Référence:
1. «Processus adiabatique - Définition, équation, processus adiabatique réversible, exemple, différences, vidéo et FAQ."Byju's, 4 août. 2021.
Image gracieuseté:
1. «Adiabatique» par l'utilisateur: Stanered - Image: adiabatique.png (cc by-sa 3.0) via Commons Wikimedia


