Différence entre le xylène et l'acétone
Le différence clé entre le xylène et l'acétone est que Le xylène est un solvant bon marché et moins toxique, tandis que l'acétone est un solvant coûteux et plus toxique.
Le xylène et l'acétone sont importants comme solvants dans les laboratoires de chimie. Cependant, ce sont deux composés différents, et leurs propriétés sont également très différentes les unes des autres.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le xylène
3. Qu'est-ce que l'acétone
4. Comparaison côte à côte - xylène vs acétone sous forme tabulaire
5. Résumé
Qu'est-ce que le xylène?
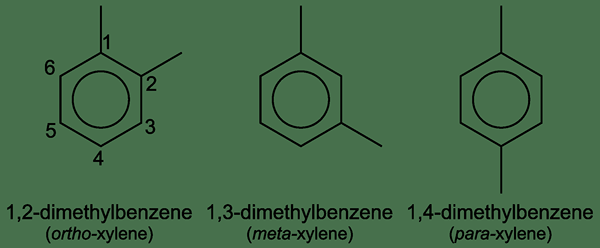
Le xylène est un composé organique ayant la formule chimique (ch3)2C6H4. Nous pouvons l'appeler diméthylbenzène car il a un benzène avec deux groupes méthyliques attachés. De plus, ce composé se produit dans l'un des trois isomères dont les positions des groupes méthyle sur le cycle benzène sont différentes les unes des autres. Tous ces trois isomères se produisent sous forme de liquides inflammables incolores; Plus précisément, un mélange de ces isomères est appelé «xylènes».

Figure 01: Isomères de xylène
Nous pouvons produire ce composé par réforme catalytique pendant le raffinage du pétrole ou par carbonisation du charbon pendant la fabrication de carburant de coke. Cependant, dans les industries, la production de xylène se fait par méthylation du toluène et du benzène.
Le xylène est un solvant non polaire. Il est cependant coûteux et relativement toxique. La nature non polaire est due à la faible différence d'électronégativité entre C et H. Par conséquent, le xylène a tendance à bien dissoudre les substances lipophiles.
Qu'est-ce que l'acétone?
L'acétone est un composé organique ayant la formule chimique (ch3)2CO. Il se produit comme un liquide incolore et inflammable qui est très volatile. C'est la cétone la plus simple et la plus petite. La masse molaire est de 58.08 g / mol. Il a une odeur piquante et irritante, mais nous pouvons la définir comme une odeur florale de concombre. Il est miscible avec l'eau. De plus, ce composé est commun en tant que solvant polaire. La polarité est due à la haute différence d'électronégativité entre le carbone et les atomes d'oxygène du groupe carbonyle. Cependant, ce n'est pas beaucoup polaire. Ainsi, il peut dissoudre à la fois des substances lipophiles et hydrophiles.
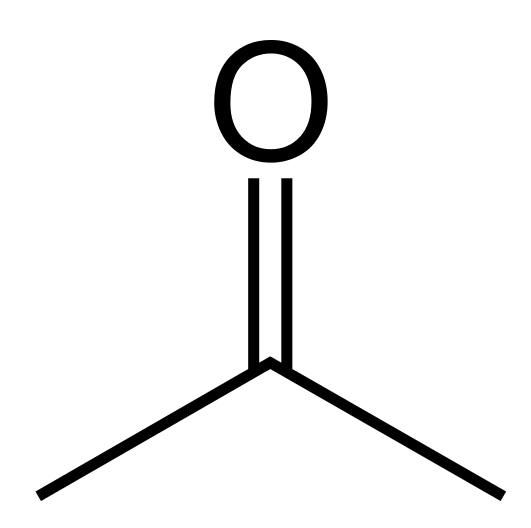
Figure 02: Structure chimique de l'acétone
Notre corps peut produire de l'acétone dans des processus métaboliques normaux et le élimine également du corps à travers différents mécanismes. Dans une échelle industrielle, la méthode de production comprend une production directe ou indirecte à partir de propylène. Le processus commun est le processus Cumene.
Quelle est la différence entre le xylène et l'acétone?
Le xylène est un composé organique ayant la formule chimique (ch3)2C6H4 tandis que l'acétone est un composé organique ayant la formule chimique (ch3)2CO. La principale différence entre le xylène et l'acétone est que le xylène est un solvant bon marché et moins toxique, tandis que l'acétone est un solvant coûteux et plus toxique. De plus, le xylène est non polaire et l'acétone est moins polaire; Par conséquent, le xylène peut dissoudre les substances lipophiles, mais l'acétone peut dissoudre les substances lipophiles et hydrophiles.
En dessous de l'infographie résume la différence entre le xylène et l'acétone.
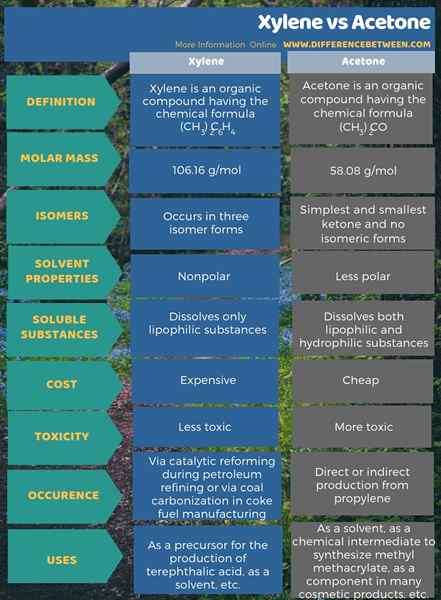
Résumé - xylène vs acétone
Le xylène est un composé organique ayant la formule chimique (ch3)2C6H4 tandis que l'acétone est un composé organique ayant la formule chimique (ch3)2CO. La principale différence entre le xylène et l'acétone est que le xylène est un solvant bon marché et moins toxique, tandis que l'acétone est un solvant coûteux et plus toxique.
Image gracieuseté:
1. «IUPAC-cyclique» par FvasConcellos 20:19, 8 janvier 2008 (UTC). Image originale de DRBOB (Talk · Contribs). - Version vectorielle de l'image: IUPAC-cyclique.png par drbob (parler · contribs) (cc by-sa 3.0) via Commons Wikimedia
2. «Acétone-2D-squelettique» par FvasConcellos - Version vectorielle du fichier: acétone-2d-squelettique.PNG par Ben Mills (domaine public) via Commons Wikimedia


