Différence entre les éléments transuraniques et les radio-isotopes
Le différence clé entre les éléments transuraniques et les radio-isotopes Les éléments transuraniques sont les éléments chimiques ayant des nombres atomiques supérieurs à 92, tandis que les radio-isotopes sont des atomes instables qui sont radioactifs.
Les éléments transuraniques et les radio-isotopes sont des éléments chimiques radioactifs. La plupart du temps, les atomes radioactifs ont un nombre atomique élevé, mais parfois il peut y avoir des isotopes rares de certains éléments chimiques avec un petit nombre atomique, qui sont radioactifs en raison d'un déséquilibre de protons et de neutrons dans leurs noyaux.
CONTENU
1. Aperçu et différence clé
2. Quels sont les éléments transuraniques
3. Que sont les radio-isotopes
4. Comparaison côte à côte - Éléments transuraniques vs radio-isotopes sous forme tabulaire
5. Résumé
Quels sont les éléments transuraniques?
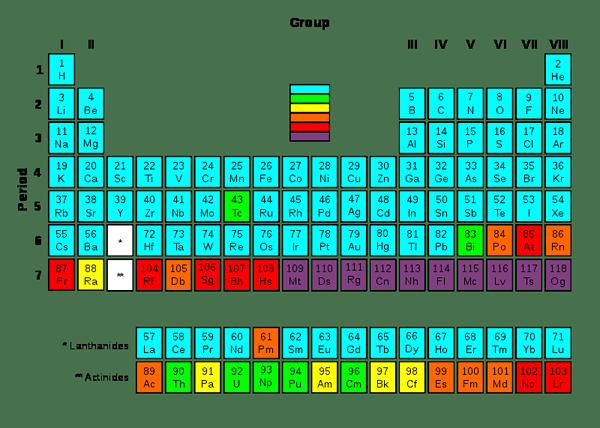
Les éléments transuraniques ou les éléments transuranium sont des éléments chimiques ayant des nombres atomiques supérieurs à 92. Le nombre atomique d'uranium est de 92; Par conséquent, la série d'éléments transuraniques commence par l'uranium, qui mène le nom de cette série (trans + uranium). Tous les membres de cette liste sont radioactifs en raison de leur nature instable.
La plupart des éléments chimiques du tableau périodique ont des isotopes que nous pouvons trouver dans l'univers comme des atomes stables ou comme des éléments chimiques ayant une très longue demi-vie. Ces éléments chimiques sont dans la plage de 1 à 92 nombres atomiques.

Figure 01: Éléments transuraniques
Nous pouvons générer des éléments transuraniques en utilisant des éléments synthétiques, en utilisant des réacteurs nucléaires ou en utilisant des accélérateurs de particules. Il existe une relation entre le nombre atomique et la demi-vie de ces éléments. Les demi-vies diminuent généralement avec l'augmentation des nombres atomiques. Cependant, il peut y avoir quelques exceptions en raison de certains isotopes; Par exemple, des isotopes de curium et de dubnium.
Liste des éléments transuraniques
- Actinides
- Neptunium
- Plutonium
- Amérique
- Curium
- Berkelium
- Californium
- Einsteinium
- Fermium
- Mendilevium
- Nobelium
- Lawrencium
- Éléments transactinides
- Rutherfordium
- Dubnium
- Mer
- Bohrium
- Carreau
- Meitnerium
- Darmstadtium
- Roentgenium
- Copernicium
- Nihonium
- Flérovium
- Moscovium
- Livermorium
- Ténine
- Oganesson
- Éléments de la période 8 (pas encore découvert)
Que sont les radio-isotopes?
Les radio-isotopes sont des isotopes radioactifs d'éléments chimiques. Ces isotopes sont instables car ils ont un excès d'énergie nucléaire. Il existe trois façons dont un radio-isotope libère cette énergie nucléaire:
- Comme le rayonnement gamma
- Libérer un électron de conversion
- Émission de particules alpha ou bêta
Si l'une des trois actions ci-dessus se produit, nous disons que la décroissance radioactive a eu lieu. Nous nommons ces émissions comme un rayonnement ionisant parce que ces rayons émis peuvent ioniser un autre atome pour libérer un électron.

Figure 02: Americium est un radio-isotope
Tous les éléments chimiques peuvent exister sous forme d'atomes radioactifs sous leurs formes isotopiques. Par exemple, même l'hydrogène l'élément le plus léger a un isotope radioactif - tritium. De plus, certains éléments chimiques n'existent que comme éléments radioactifs.
Quelle est la différence entre les éléments transuraniques et les radio-isotopes?
Les éléments transuraniques et les radio-isotopes sont des éléments chimiques radioactifs. La principale différence entre les éléments transuraniques et les radio-isotopes est que les éléments transuraniques sont les éléments chimiques ayant des nombres atomiques supérieurs à 92, tandis que les radio-isotopes sont des atomes instables qui sont radioactifs.
De plus, les éléments transuraniques n'existent que sous forme d'atomes radioactifs, tandis que les radio-isotopes sont des isotopes d'éléments chimiques qui existent sous forme d'atomes radioactifs. Par exemple, les séries d'actinides, les séries transactinides et les éléments de la période 8 sont des éléments transuraniques. L'isotope du tritium d'hydrogène est un radio-isotope très léger avec un nombre atomique très faible.
L'infographie ci-dessous résume la différence entre les éléments transuraniques et les radio-isotopes.

Résumé - Éléments transuraniques vs radio-isotopes
Les éléments transuraniques et les radio-isotopes sont des éléments chimiques radioactifs. La principale différence entre les éléments transuraniques et les radio-isotopes est que les éléments transuraniques sont les éléments chimiques ayant des nombres atomiques supérieurs à 92, tandis que les radio-isotopes sont des atomes instables qui sont radioactifs.
Référence:
1. Faire frire, Brian. «Utilisation de traceurs isotopes stables.”Écologie isotope stable, 2006, pp. 40-75., doi: 10.1007 / 0-387-33745-8_3.
2. «Radio-isotopes.»IAEA, IAEA, 15 juillet 2016, disponible ici.
Image gracieuseté:
1. «Radioactivité de la table périodique» par périodique_table_armtuk3.SVG: ARMTUK (Talk) Travail dérivé: Alessio Rolleri (Talk) Travail dérivé: Gringer (Talk) - Périodic_table_armtuk3.SVG (CC BY-SA 3.0) via Commons Wikimedia
2. «Échantillon de l'Amerium-241 de Smoke Detector» par MedicalReference - auto-photographié (CC BY-SA 3.0) via Commons Wikimedia


