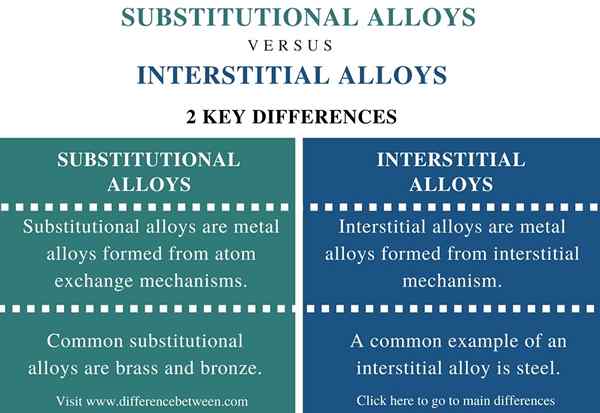
Différence entre les alliages substitutionnels et interstitiels
Le différence clé entre les alliages substitutionnels et interstitiels est que le Les alliages de substitution se forment lorsqu'un atome métallique substitue un autre atome métallique de taille similaire dans le réseau métal.
Un alliage est un mélange de métaux. Cependant, parfois ce mélange pourrait contenir des non-métaux également. La production d'alliages métalliques implique le mélange de métaux fondus. Là, la taille des atomes métalliques détermine le type d'alliage formé; c'est-à-dire que si les atomes métalliques sont de la même taille, alors l'alliage formé est substitutionnel. Si les atomes métalliques ont des tailles différentes, alors l'alliage résultant est interstitiel.

CONTENU
1. Aperçu et différence clé
2. Que sont les alliages substitutionnels
3. Que sont les alliages interstitiels
4. Comparaison côte à côte - substitution vs alliages interstitiels sous forme tabulaire
5. Résumé
Que sont les alliages substitutionnels?
Les alliages de substitution sont des alliages métalliques qui se forment à partir de mécanismes d'échange d'atomes. Ici, les atomes métalliques d'un métal différent (l'autre métal mélangé pour former l'alliage) substituent les atomes métalliques d'un réseau métallique.

Figure 01: un alliage de substitution
Cette substitution ne se produit que si les atomes métalliques sont de tailles similaires. Certains alliages de substitution communs comprennent le laiton, le bronze, etc. Là, les atomes de cuivre de la substitut en réseau métallique par des atomes de métal en étain ou en zinc.
Que sont les alliages interstitiels?
Les alliages interstitiels sont des alliages métalliques qui se forment à partir du mécanisme interstitiel. De plus, ce mécanisme implique l'insertion de petits atomes dans les trous des réseaux métalliques. Un réseau métallique contient de grands atomes de métal dans une structure de réseau. Il existe également des électrons délocalisés entourant les atomes métalliques. Par conséquent, lorsqu'un métal fondu se mélange avec un métal différent ayant de petits atomes, un alliage interstitiel se forme. Cependant, ces petits atomes doivent être suffisamment petits pour s'insérer dans les trous du réseau.

Figure 02: un alliage interstitiel
Certains exemples de petits atomes capables d'insérer dans un réseau métallique comprennent l'hydrogène, le carbone, le bore et l'azote. Un exemple commun d'alliage interstitiel est l'acier. L'acier contient du fer, du carbone et quelques autres éléments. Il n'y a pas de substitutions qui se produisent lors de la formation d'un alliage interstitiel car les atomes mélangés ne sont pas assez grands pour remplacer un atome métallique.
Quelle est la différence entre les alliages substitutionnels et interstitiels?
Substitution vs alliages interstitiels | |
| Alliages substitutionnels Les alliages métalliques sont-ils formés à partir de mécanismes d'échange d'atomes. | Alliages interstitiels Les alliages métalliques sont-ils formés à partir du mécanisme interstitiel. |
| Mécanisme de formation | |
| Formulaires via le mécanisme d'échange des atomes. | Formes via le mécanisme interstitiel. |
| Taille des atomes | |
| Dans cette formation d'alliage, un métal fondu est mélangé à un autre métal fondu avec des tailles atomiques similaires. | Dans cette formation d'alliage, un métal fondu est mélangé à un composé ayant de petits atomes capables d'insérer dans les trous du réseau métallique. |
| Exemples courants | |
| Laiton et bronze | Acier |
Résumé - Substitution vs alliages interstitiels
Les alliages sont des mélanges de métaux et d'autres non-métaux. Ces alliages ont des propriétés améliorées que les métaux individuels. Il existe deux types d'alliages, à savoir les alliages substitutifs et les alliages interstitiels. La différence entre les alliages substitutionnels et interstitiels est que les alliages de substitution se forment lorsqu'un atome métallique substitue un autre atome métallique de taille similaire dans le réseau métallique tandis que.
Référence:
1. LibreTexts. «6.7a: alliages substitutionnels.”Chemistry LibreTexts, LibreTexts, 12 décembre. 2016. Disponible ici
2. LibreTexts. «6.7b: alliages interstitiels.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.`` ALLIAL SUBSTITUTIONAL 'BY JOHN APLESSED - Propre travaux, (domaine public) via Commons Wikimedia
2.`` ALLIAL Interstitial'By John Applessed - Propre travaux, (domaine public) via Commons Wikimedia


