Différence entre le singulet et l'état triplet
Le différence clé entre le singulet et l'état triplet est que le L'état singulet ne montre qu'une seule ligne spectrale tandis que l'état de triplet montre une triple division des lignes spectrales.
Les termes que les États-Unis et les états triplet sont discutés sous la mécanique quantique. Nous pouvons décrire ces termes concernant le rotation du système, je.e. atome. En mécanique quantique, le spin n'est pas une rotation mécanique. C'est un concept qui caractérise l'élan angulaire d'une particule.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'État singulet
3. Qu'est-ce que l'état du triplet
4. Comparaison côte à côte - État singulet vs état triplet sous forme tabulaire
5. Résumé
Qu'est-ce que l'État singulet?
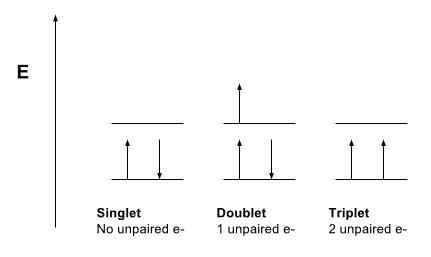
Un état de singulet fait référence à un système dans lequel tous les électrons sont jumelés. Le moment angulaire net des particules dans ce type de système est nul. Par conséquent, nous pouvons dire que le numéro quantique de spin global, s est nul (s = 0). De plus, si nous prenons le spectre de ce système, il montre une ligne spectrale et, par conséquent, a obtenu le nom «Singlet State». De plus, presque toutes les molécules que nous connaissons existent dans l'état singulier, mais l'oxygène moléculaire est une exception.

Figure 1: Comparaison du singulet, du doublet et des états du triplet
À titre d'exemple, la paire de particules liée la plus simple possible ayant un état singulet est le positronium, qui a un électron et un positron. Ces deux particules sont liées par leur charge électrique opposée. De plus, les électrons appariés d'un système ayant un état singulet ont des orientations de spin parallèles.
Qu'est-ce que l'état du triplet?
L'état de triplet d'un système décrit que le système a deux électrons non appariés. Le moment angulaire net des particules dans ce type de système est 1. Par conséquent, le nombre quantique de spin est 1. De plus, cela permet trois valeurs du moment angulaire comme -1, 0 et +1. Par conséquent, les lignes spectrales que nous obtenons pour ce type de système divisées en trois lignes, et donc, a obtenu le nom de triplet State.
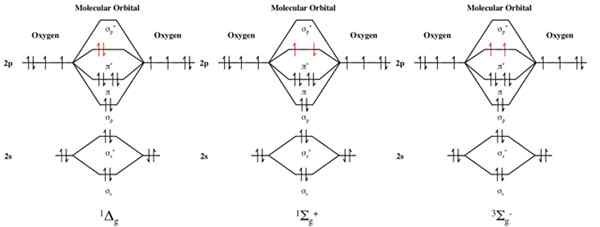
Les trois configurations électroniques des orbitales moléculaires de l'oxygène moléculaire, O2. De gauche à droite, les diagrammes sont destinés à: 1ΔG Oxygène singulet (premier état excité), 1σ + G oxygène singulet (deuxième état excité) et 3σ− g d'oxygène triplet (état fondamental).
De plus, le meilleur exemple d'un état triplet est l'oxygène moléculaire. À température ambiante, cet oxygène moléculaire donne un triple séparation dans les lignes spectrales.
Quelle est la différence entre le singulet et l'état triplet?
Un état de singulet fait référence à un système dans lequel tous les électrons sont jumelés. Tandis que l'état de triplet d'un système décrit que le système a deux électrons non appariés. La principale différence entre le singulet et l'état de triplet est que l'État singulet ne montre qu'une seule ligne spectrale tandis que l'état de triplet montre la triple division des lignes spectrales.
De plus, une autre différence entre le singulet et l'état de triplet est que le nombre quantique de spin d'un état singulet est s = 0 alors qu'il est s = 1 pour un état de triplet. D'ailleurs, presque toutes les molécules que nous connaissons existent à l'état singulet à l'exception de l'oxygène moléculaire. Tandis que l'oxygène moléculaire se produit à l'état du triplet.
Ci-dessous, l'info-graphique résume la différence entre le singulet et l'état du triplet.
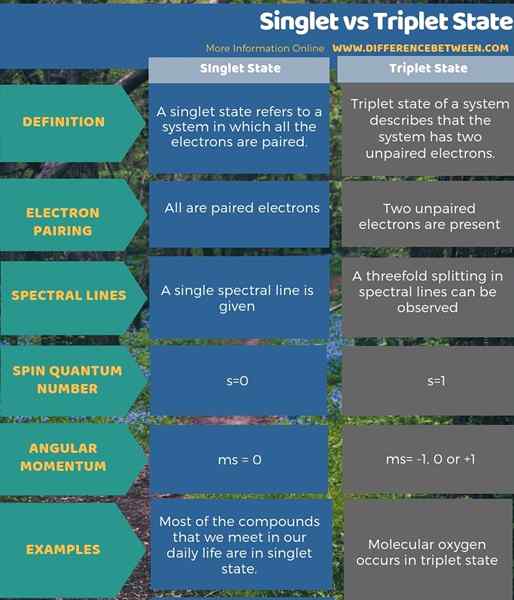
Résumé - Singlet vs Triplet State
Nous pouvons discuter des termes de l'État singulet et de l'État triplet comme faits sur des systèmes minuscules tels que les atomes. La principale différence entre le singulet et l'état de triplet est que l'état singulet ne montre qu'une seule ligne spectrale tandis que l'état de triplet montre la triple division des lignes spectrales.
Référence:
- «État du triplet." Wikipédia, Fondation Wikimedia, 16 février. 2019.
- «État singulet." Wikipédia, Fondation Wikimedia, 27 décembre. 2018.
Image gracieuseté:
- «Diagramme de multiplicité de spin» par LlightEx - Propre travaux, CC BY-SA 4.0, via les communes Wikimedia
- «Deux États-Unis excités par Singlet et Triplet State of Molecular Dioxygen» par Angelo Frei - Propre travaux, CC BY-SA 3.0, via les communes Wikimedia


