Différence entre le défaut de Schottky et les défauts de Frenkel
Le différence clé entre le défaut de Schottky et le défaut de Frenkel est que Le défaut de Schottky réduit la densité d'un cristal alors que le défaut de Frenkel n'affecte pas la densité d'un cristal. Outre la différence clé ci-dessus, une autre différence importante entre le défaut de Schottky et le défaut de Frenkel est que le défaut de Schottky provoque une réduction de la masse du cristal tandis que le défaut de Frenkel n'affecte pas la masse du cristal.
Le terme réseau de cristal décrit la disposition symétrique des atomes d'un cristal. Le défaut de Schottky et le défaut de Frenkel sont deux formes de défauts ponctuels qui se produisent dans un réseau cristallin. Un défaut ponctuel est un point vacant qui crée en raison de la perte d'un atome du réseau cristallin. Ces défauts provoquent une irrégularité des réseaux cristallins.
CONTENU
1. Aperçu et différence clé
2. Quel est le défaut Schottky
3. Qu'est-ce que le défaut de Frenkel
4. Comparaison côte à côte - défaut de schottky vs défaut de frenkel sous forme tabulaire
5. Résumé
Quel est le défaut Schottky?
Le défaut de Schottky est une forme de défaut ponctuel qui se forme en raison de la perte d'un atome dans les unités stoechiométriques du réseau cristallin. Ce défaut de point a obtenu son nom après le scientifique Walter H. Schottky. Nous pouvons observer ce défaut dans les cristaux ioniques ou non ioniques. Ce défaut survient lorsqu'un élément constitutif quitte le réseau cristallin.

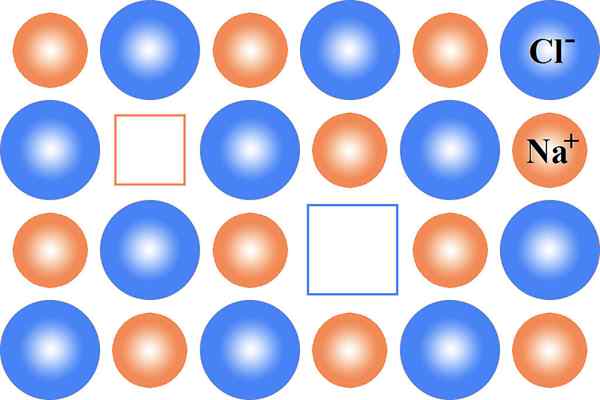
Figure 01: Défaut Schottky dans NaCl
Bien que le réseau perd un atome, il n'affecte pas l'équilibre de charge du réseau car les atomes laissent une unité stœchiométrique du réseau. Une unité stoichiométrique contient des atomes de charge opposée dans des rapports égaux.
Lorsque ce défaut se produit, il réduit la densité du réseau cristallin. Cette forme de défauts ponctuelles est courante dans les composés ioniques. Quand il se produit dans des cristaux non ioniques, nous l'appelons un défaut de vacance. La plupart du temps, ce défaut se produit dans des réseaux cristallins ayant des atomes avec des tailles presque égales. Ex: NaCl Lattice, KBR Lattice, etc.
Qu'est-ce que le défaut de Frenkel?
Le défaut de Frenkel est une forme de défaut ponctuel dans lequel le défaut se produit en raison de la perte d'un atome ou d'un petit ion à partir du réseau cristallin. Cette perte crée un point vacant dans le réseau. Les synonymes pour ce défaut sont le trouble Frenkel et la paire de frenkel. Le défaut a obtenu son nom après le scientifique Yakov Frenkel.
Si un petit ion quitte le réseau cristallin, c'est un cation (un ion chargé positivement). Cet ion occupe un emplacement à proximité du point vacant. Par conséquent, ce défaut n'affecte pas la densité du réseau cristallin. C'est parce que l'atome ou les ions ne laisse pas complètement le réseau. Cette forme de défauts ponctuelles est courante dans les réseaux ioniques. Contrairement à un défaut de Schottky, ce défaut se produit dans les réseaux avec des atomes ou des ions ayant des tailles différentes.
Quelle est la différence entre le défaut Schottky et le défaut de Frenkel?
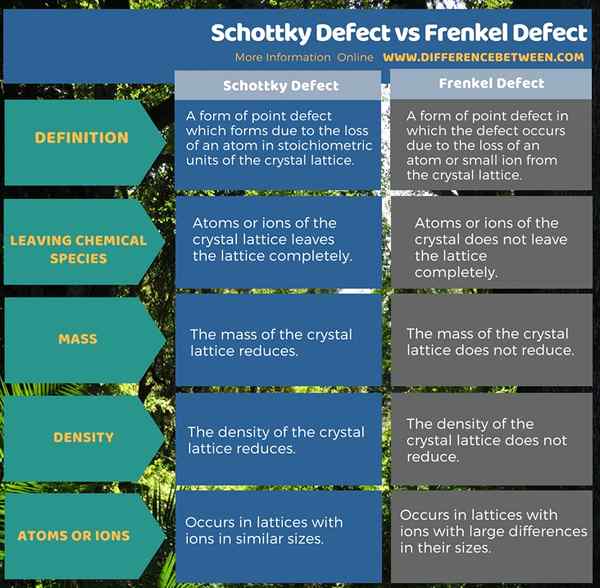
Le défaut de Schottky est une forme de défaut ponctuel qui se forme en raison de la perte d'un atome dans les unités stoechiométriques du réseau cristallin. Le défaut de Frenkel est une forme de défaut ponctuel dans lequel le défaut se produit en raison de la perte d'un atome ou d'un petit ion à partir du réseau cristallin. Le défaut de Schottky réduit la densité du réseau cristallin tandis que le défaut de Frenkel n'affecte pas la densité du réseau cristallin.
Résumé - Défaut de Schottky vs défaut de Frenkel
Les défauts ponctuels sont des défauts dans les réseaux cristallins qui se produisent en raison de la perte d'atomes ou d'ions du réseau et donc, formant un point vacant. Le défaut Schottky et le défaut de Frenkel sont deux formes de défauts ponctuels. La différence entre le défaut de Schottky et le défaut de Frenkel est que le défaut de Schottky réduit la densité d'un cristal alors que le défaut de Frenkel n'affecte pas la densité d'un cristal.
Référence:
1. «Défaut Schottky.»Wikipedia, Wikimedia Foundation, 12 mai 2018. Disponible ici
2. «Défauts cristallins - défauts ponctuels.«Conducteurs et isolants. Disponible ici
Image gracieuseté:
1.'NaCl - Schottky Defect'By Vladvd - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


