Différence entre les éléments représentatifs et de transition
Différence clé - Représentant vs éléments de transition
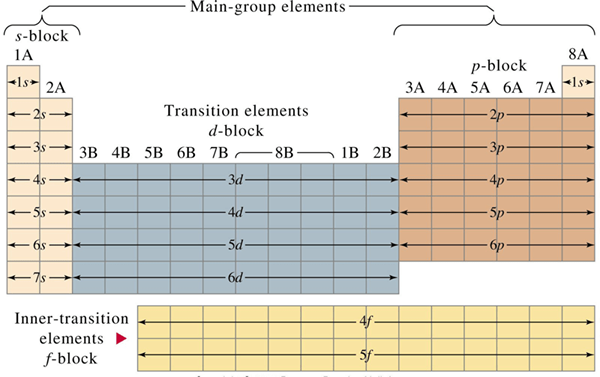
Le tableau périodique des éléments est un arrangement tabulaire de tous les éléments chimiques connus en fonction de leurs nombres atomiques. Il y a des lignes, des périodes et des colonnes ou des groupes dans le tableau périodique. Il y a des tendances périodiques dans le tableau périodique. Tous les éléments du tableau périodique peuvent être divisés en deux groupes en tant qu'éléments représentatifs et éléments de transition. Le différence clé entre les éléments représentatifs et les éléments de transition est que Les éléments représentatifs sont les éléments chimiques du groupe 1, du groupe 2 et des groupes de 13 à 18.
CONTENU
1. Aperçu et différence clé
2. Quels sont les éléments représentatifs
3. Quels sont les éléments de transition
4. Comparaison côte à côte - Éléments de transition représentatifs vs sous forme tabulaire
5. Résumé
Quels sont les éléments représentatifs?
Les éléments représentatifs sont les éléments chimiques du groupe 1, du groupe 2 et des groupes de 13 à 18. Les éléments représentatifs sont également connus sous le nom de «éléments du groupe A» ou des «éléments de blocs S et p» ou des «éléments de groupe principaux», ce qui signifie que les éléments représentatifs comprennent les groupes suivants d'éléments chimiques;
-
S éléments de bloc (métaux alcalins et métaux de la Terre alcalins)
Les éléments de blocs ont leurs électrons de valence dans les orbitales S à l'extérieur et sont en deux types sous forme de métaux alcalins et de métaux de la Terre alcalins ainsi que de l'hydrogène et de l'hélium. Les métaux alcalins sont des éléments du groupe 1 (à l'exclusion de l'hydrogène) tandis que les métaux terrestres alcalins sont des éléments du groupe 2. Ces métaux sont nommés comme tels parce qu'ils forment des composés de base ou alcalins. Les métaux alcalins comprennent le lithium, le sodium, le potassium, le rubidium, le césium et le francium. Les métaux terrestres alcalins comprennent le béryllium, le magnésium, le calcium, le strontium, le baryum et le radium.

Figure 01: Arrangement de représentant et élément de transition dans le tableau périodique
-
P Block Elements (non-métaux, halogènes, gaz nobles)
Les éléments du bloc P ont leurs électrons de valence dans les orbitales p les plus externes. Presque tous les éléments du bloc P sont des non-métaux, y compris certains éléments métalloïdes (à l'exclusion de l'hélium, car c'est un élément de bloc S). Il y a une tendance périodique pendant les périodes et des groupes dans le bloc P. Les métalloïdes incluent le bore, le silicium, le germanium, l'arsenic, l'antimoine et le tellurium. Les gaz nobles sont les éléments du groupe 18 (qui ont terminé eConfigurations de lectron). Tous les autres sont des non-métaux.
Quels sont les éléments de transition?
Les éléments de transition sont des éléments chimiques qui ont des électrons D non appariés au moins dans un cation stable qui peut se former. Tous les éléments de transition sont des métaux. Ils ont leurs électrons de valence dans les orbitales d les plus externes. Par conséquent, tous les éléments chimiques du groupe 3 au groupe 12 sont des métaux de transition à l'exclusion du zinc (car le zinc n'a pas d'électrons non appariés et de Zn+2 n'a pas non plus d'électrons non appariés. Zn+2 est le seul cation stable du zinc).
Presque tous les métaux de transition ont plusieurs états d'oxydation stables dans différents composés. Tous ces composés sont très colorés. Et aussi, les légendes contenant les mêmes éléments de transition avec différents états d'oxydation peuvent avoir des couleurs différentes basées sur l'état d'oxydation (la couleur du cation varie avec l'état d'oxydation du même élément chimique). La raison de cette couleur est la présence d'électrons D non appariés (il permet aux électrons de passer d'une orbite à l'autre en absorbant l'énergie. Lorsque ces électrons reviennent à l'orbitale précédente, il émet l'énergie absorbée comme une lumière visible).
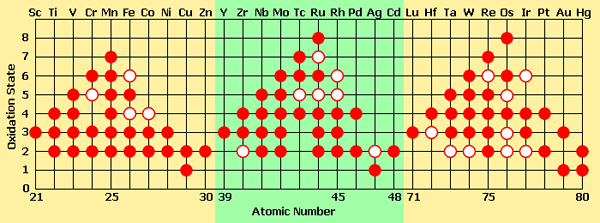
Figure 02: différents états d'oxydation formés par des métaux de transition
Les lanthanides et les actinides sont également nommés comme des «métaux de transition intérieurs» car leurs électrons de valence sont dans leurs orbitales F de l'avant-dernière coque d'électrons. Ces éléments peuvent être vus dans le bloc F du tableau périodique.
Quelle est la différence entre les éléments représentatifs et de transition?
Éléments de transition représentatifs vs | |
| Les éléments représentatifs sont les éléments chimiques du groupe 1, du groupe 2 et des groupes de 13 à 18. | Les éléments de transition sont des éléments chimiques qui ont des électrons D non appariés au moins dans un cation stable qui peut se former. |
| Membres | |
| Les éléments représentatifs incluent les éléments de bloc S et P. | Les éléments de transition incluent les éléments de blocs D et F Bloc. |
| Groupes | |
| Les éléments représentatifs sont dans le groupe1, le groupe 2 et les groupes 13 à 18. | Les éléments de transition sont dans les groupes 3 à 12. |
| Couleurs | |
| La plupart des composés formés par des éléments représentatifs sont incolores. | Tous les composés formés par des éléments de transition sont colorés. |
Résumé - Représentant vs éléments de transition
Les éléments représentatifs sont les principaux éléments de groupe qui comprennent les métaux alcalins, les métaux terrestres alcalins, les non-métaux et les gaz nobles. Les métaux de transition sont dans le bloc D et le bloc F du tableau périodique. La différence entre les éléments représentatifs et les éléments de transition est que les éléments représentatifs sont les éléments chimiques du groupe 1, du groupe 2 et des groupes de 13 à 18 ans tandis que les éléments de transition sont des éléments chimiques du groupe 3 au groupe 12, y compris les lanthanides et les actinides.
Référence:
1.«Définition de l'élément représentatif.«Science, disponible ici
2."Métal de transition.»Wikipedia, Wikimedia Foundation, 25 février. 2018. Disponible ici
3.«Représentant et éléments de transition;) - Un deck Haiku de Jade Bailey.”Deck Haiku: logiciel de présentation et outils de présentation en ligne. Disponible ici
Image gracieuseté:
1.'PTABLE STRUCTURE' par sch0013r, (CC By-SA 3.0) via Commons Wikimedia
2.«Transition Metal Oxydation States 2'By Aucun auteur lisible par machine fourni. Felix Wan a supposé (sur la base des réclamations du droit d'auteur). (CC BY-SA 3.0) via Commons Wikimedia


