Différence entre la vitesse de réaction et la constante de vitesse spécifique
Le différence clé entre la vitesse de réaction et la constante de vitesse spécifique est que La vitesse de réaction donne une indication de la vitesse à laquelle les réactions sont converties en produits tandis que la constante de vitesse spécifique est constante de proportionnalité.
Lorsqu'un ou plusieurs réactifs sont convertis en produits, ils peuvent passer par différentes modifications et changements d'énergie. Les liaisons chimiques dans les réactifs sont cassées et de nouvelles liaisons sont formées pour générer des produits totalement différents des réactifs. Ces types de modifications chimiques sont appelées réactions chimiques. Il existe de nombreuses variables contrôlant les réactions. En étudiant la thermodynamique et la cinétique, nous pouvons tirer de nombreuses conclusions sur une réaction et comment nous pouvons les contrôler. La thermodynamique est l'étude des transformations de l'énergie. Il ne concerne que l'énergie et la position de l'équilibre dans une réaction. Il n'a rien à dire sur la vitesse à laquelle l'équilibre est atteint. Cette question est le domaine de la cinétique.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la vitesse de réaction
3. Quelle est la constante de taux spécifique
4. Comparaison côte à côte - Rate de réaction vs constante de vitesse spécifique dans la forme tabulaire
5. Résumé
Qu'est-ce que la vitesse de réaction?
La vitesse de réaction est simplement l'indication de la vitesse de la réaction. Il peut être considéré comme un paramètre qui détermine à quelle vitesse ou à quelle vitesse la réaction est lente. Naturellement, certaines réactions sont très lentes, donc nous ne pouvons même pas voir la réaction se dérouler à moins que nous l'observons pendant très longtemps. Par exemple, l'altération rocheuse par les processus chimiques est une réaction vraiment lente qui se déroule au fil des ans. En revanche, la réaction entre un morceau de potassium et d'eau est très rapide et produit une grande quantité de chaleur; Ceci est considéré comme une réaction vigoureuse.
Considérez la réaction suivante où les réactifs A et B vont aux produits C et D.
A A + B B → C C + D D
La vitesse de réaction peut être donnée en termes de deux réactifs ou produits.
Taux = - (1 / a) d [a] / dt = - (1 / b) d [b] / dt = - (1 / c) d [c] / dt = - (1 / d) d [d ] / dt
A, B, C et D sont des coefficients stoechiométriques des réactifs et des produits. Pour les réactifs, l'équation de taux est écrite avec un signe moins car les produits s'épuisent à mesure que la réaction se déroule. Cependant, à mesure que les produits augmentent, ils reçoivent des signes positifs.

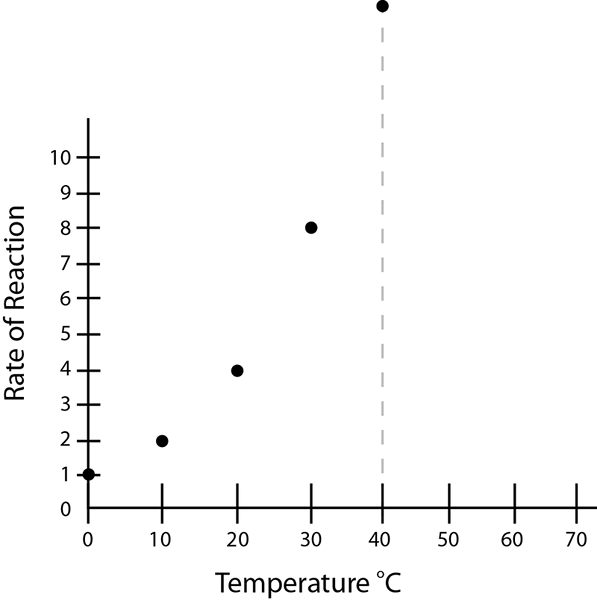
Figure 01: La vitesse de réaction augmente avec l'augmentation de la température
La cinétique chimique est l'étude des taux de réaction et il existe de nombreux facteurs affectant la vitesse de la réaction. Ces facteurs comprennent les concentrations des réactifs, des catalyseurs, de la température, des effets de solvant, du pH, parfois des concentrations de produit, etc. Ces facteurs peuvent être optimisés pour avoir le taux de réaction maximal ou peuvent être ajustés pour manipuler les taux de réaction requis.
Quelle est la constante de taux spécifique?
Si nous écrivons l'équation de vitesse par rapport au réactif A dans la réaction ci-dessus, c'est comme le suivant.
R = -k [a] a [b] b
Dans cette réaction, k est la constante de vitesse. Ceci est connu comme constante de vitesse spécifique lorsque la concentration de chaque réactif est l'unité; je.e. un mole / dm3. C'est une constante de proportionnalité qui dépend de la température. Vitesse et constante de vitesse spécifique d'une réaction peuvent être trouvées par des expériences.
Quelle est la différence entre la vitesse de réaction et la constante de vitesse spécifique?
La vitesse de réaction donne une indication de la vitesse à laquelle les réactions sont converties en produits tandis que la constante de vitesse spécifique est constante de proportionnalité. C'est donc la principale différence entre la vitesse de réaction et la constante de vitesse spécifique. Plus important encore, la constante de vitesse spécifique fait partie de la vitesse de réaction. La constante de vitesse spécifique ne peut que donner une déclaration valide de la vitesse de réaction.

Résumé - Rate de réaction VS constante de vitesse spécifique
La principale différence entre la vitesse de réaction et la constante de vitesse spécifique est que la vitesse de réaction donne une indication de la vitesse à laquelle les réactions sont converties en produits tandis que la constante de vitesse spécifique est une constante de proportionnalité.
Image gracieuseté:
1. «Augmentation du taux de réaction avec l'augmentation de la température» par Brazosport College - propre travail (CC BY-SA 3.0) via Commons Wikimedia


