Différence entre électrode polarisable et non polarisable

Le différence clé entre une électrode polarisable et non polarisable est que Les électrodes polarisables ont une séparation de charge à la limite d'électrolyte électrode tandis que les électrodes non polarisables n'ont pas de séparation de charge à cette limite électrode-électrolyte.
La polarisation des électrodes dans l'électrochimie fait référence à la réduction des performances d'une batterie. Il s'agit d'un terme collectif qui est utilisé pour certains effets secondaires mécaniques des processus électrochimiques par lesquels des barrières d'isolement se développent à l'interface entre l'électrode et l'électrolyte. Ces effets secondaires peuvent influencer le mécanisme de réaction à l'intérieur de la batterie ainsi que la cinétique chimique de la corrosion et du dépôt métallique. Les principaux effets secondaires comprennent la polarisation d'activation et la polarisation de la concentration. La polarisation d'activation fait référence à l'accumulation de gaz à l'interface entre l'électrode et l'électrolyte tandis que la polarisation de la concentration fait référence à l'épuisement inégal des réactifs dans l'électrolyte, provoquant un gradient de concentration dans les couches limites.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une électrode polarisable
3. Qu'est-ce qu'une électrode non polarisable
4. Comparaison côte à côte - cellule électrochimique vs cellule galvanique sous forme tabulaire
5. Résumé
Qu'est-ce qu'une électrode polarisable?
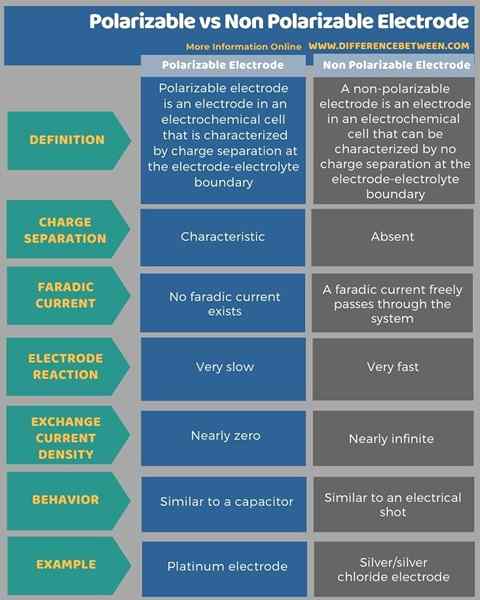
Une électrode polarisable est une électrode dans une cellule électrochimique caractérisée par une séparation de charges à la limite d'électrolyte électrode. Nous pouvons observer que ce type d'électrode polarisable est électriquement équivalent à un condensateur. Une électrode polarisable idéale est une substance hypothétique qui se caractérise par l'absence d'un courant CC net entre les deux côtés de la double couche électrique. En d'autres termes, il n'y a pas de courant faradique existant entre la surface de l'électrode et l'électrolyte. Par conséquent, tout courant transitoire qui circule dans ce système est considéré comme un courant non faradique.

Figure 01: Batteries: petites cellules électrochimiques avec électrodes
Le comportement de ce type d'électrode est dû à la réaction de l'électrode infiniment lente, ayant une densité de courant d'échange zéro, ce qui le fait se comporter comme un condensateur au moyen de l'électricité. Le concept chimique de cette électrode polarisable a été développé par le scientifique F.O.Koenig en 1934. L'électrode en platine est un exemple classique d'une électrode polarisable.
Qu'est-ce qu'une électrode non polarisable?
Une électrode non polarisable est une électrode dans une cellule électrochimique qui peut être caractérisée par aucune séparation de charge à la limite d'électrode-électrolyte. Cela signifie que les cellules électrochimiques ayant ces électrodes ont un courant faradique qui peut passer librement sans polarisation. Une électrode idéale non polarisable est une électrode hypothétique ayant cette propriété de ne pas avoir de séparation de charges. Le potentiel d'une électrode non polarisable ne change pas de son potentiel d'équilibre lors de l'application d'un courant. Nous pouvons observer la raison de ce comportement comme la réaction d'électrode infiniment rapide qui a une densité de courant d'échange infinie. Ce type d'électrodes peut se comporter comme une photo électrique. L'électrode de chlorure d'argent / argent est un exemple classique d'une électrode non polarisable.
Quelle est la différence entre l'électrode polarisable et non polarisable?
Les électrodes polarisables et non polarisables sont les deux principaux types d'électrodes que nous pouvons trouver dans les cellules électrochimiques. La principale différence entre l'électrode polarisable et non polarisable est que les électrodes polarisables ont une séparation de charge à la limite d'électrode-électrolyte tandis que les électrodes non polarisables n'ont pas de séparation de charge à cette limite d'électro-électrolyte.
Ci-dessous, l'infographie tabule les différences entre l'électrode polarisable et non polarisable plus en détail.
Résumé - Électrode polarisable vs non polarisable
Les électrodes polarisables et non polarisables sont les deux principaux types d'électrodes que nous pouvons trouver dans les cellules électrochimiques. La principale différence entre l'électrode polarisable et non polarisable est que les électrodes polarisables ont une séparation de charge à la limite d'électrode-électrolyte tandis que les électrodes non polarisables n'ont pas de séparation de charge à cette limite d'électro-électrolyte.
Référence:
1. «Électrode polarisable non polarisable.”Jyothi Engineering College - Slideshare, 11 juillet 2014. Disponible ici.
Image gracieuseté:
1. «Batteries Rechargeables Batteries Current Free Photo» (CC0) via NeedPix


