Différence entre la multiplicité et l'ordre des liaisons
Le différence clé entre la multiplicité et l'ordre de liaison est que La multiplicité fait référence au nombre d'orientations possibles du rotation du niveau d'énergie, tandis que l'ordre des liaisons fait référence à une mesure du nombre d'électrons dans les liaisons chimiques.
La multiplicité et l'ordre des liaisons sont les propriétés des composés chimiques. Le concept de multiplicité est important dans la chimie quantique, tandis que le concept d'ordre des liaisons est important dans la dynamique moléculaire.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la multiplicité
3. Qu'est-ce que l'ordre des obligations
4. Comparaison côte à côte - multiplicité vs ordre de liaison sous forme tabulaire
5. Résumé
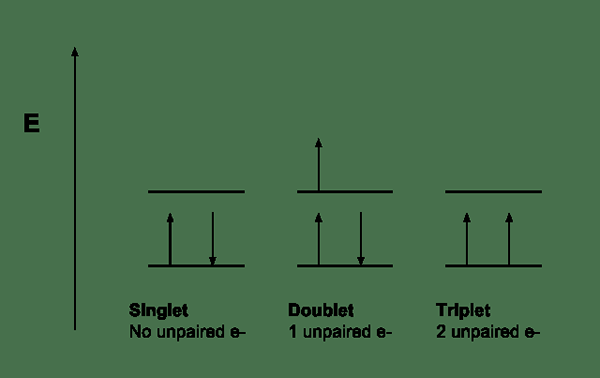
Qu'est-ce que la multiplicité?
La multiplicité fait référence au nombre d'orientations possibles de la rotation du niveau d'énergie. Ce concept est utile dans la spectroscopie et la mécanique quantique. L'équation de la mesure de la multiplicité est 2S + 1 où «S» fait référence au moment angulaire total de spin. Les valeurs que nous pouvons obtenir pour la multiplicité comprennent 1, 2, 3, 4… Nous pouvons les nommer comme des maillots, des doublets, des triplés, des quatuors, etc.

La multiplicité est mesurée par rapport au moment angulaire orbital. Cela signifie; Il est mesuré par rapport au nombre de niveaux d'énergie presque dégénérés, qui sont différents les uns des autres selon l'énergie d'interaction spin-orbite. Par exemple, les composés organiques stables ont des coquilles d'électrons complètes qui n'ont pas d'électrons non appariés. Par conséquent, ces molécules ont un simple et un état fondamental.
Qu'est-ce que l'ordre des obligations?
L'ordre des obligations fait référence à une mesure du nombre d'électrons dans les liaisons chimiques. Le concept d'ordre des obligations a été développé par Linus Pauling. Il est utile comme indicateur de la stabilité d'une liaison chimique. La valeur de l'ordre des liaisons est élevée, la liaison chimique est plus forte. S'il n'y a pas d'orbitales anticondables, l'ordre des obligations est égal au nombre de liaisons entre deux atomes d'une molécule. En effet. L'équation du calcul de l'ordre des liaisons dans une molécule particulière est la suivante:
Ordre de liaison = (Nombre d'électrons de liaison - Nombre d'électrons antibondants) / 2
Selon l'équation ci-dessus, si l'ordre de liaison est nul, les deux atomes ne sont pas liés les uns aux autres. Par exemple, l'ordre de liaison pour la molécule de dinitrogen est 3. De plus, les espèces isoélectroniques ont généralement le même ordre de liaison. En dehors de cela, le concept d'ordre des liaisons est utile dans la dynamique moléculaire et les potentiels d'ordre des liaisons.
Quelle est la différence entre la multiplicité et l'ordre des liaisons?
Le concept de multiplicité est important dans la chimie quantique, tandis que le concept d'ordre des liaisons est important dans la dynamique moléculaire. La principale différence entre la multiplicité et l'ordre des liaisons est que la multiplicité se réfère au nombre d'orientations possibles du rotation du niveau d'énergie, tandis que l'ordre des liaisons se réfère à une mesure du nombre d'électrons dans les liaisons chimiques.
L'équation pour la détermination de la multiplicité est 2S + 1 où S est le moment angulaire total de spin. L'équation de la détermination de l'ordre des liaisons est (électrons de liaison + électrons antibondants) / 2. De plus, la multiplicité est mesurée comme une valeur relative (qui est par rapport au moment angulaire orbital). Mais, l'ordre des obligations est une valeur particulière pour une liaison chimique particulière. Habituellement, si l'ordre de liaison est nul, cela signifie qu'il n'y a pas de liaison chimique.
L'infographie ci-dessous résume la différence entre la multiplicité et l'ordre des liaisons.
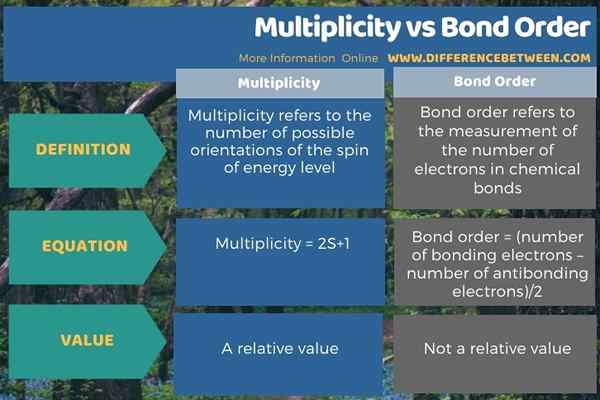
Résumé - Multiplicité vs Ordre des obligations
Le concept de multiplicité est important dans la chimie quantique, tandis que le concept d'ordre des liaisons est important dans la dynamique moléculaire. La principale différence entre la multiplicité et l'ordre des liaisons est que la multiplicité se réfère au nombre d'orientations possibles du rotation du niveau d'énergie tandis que l'ordre des liaisons se réfère à une mesure du nombre d'électrons dans les liaisons chimiques.
Référence:
1. Helmenstine, Anne Marie. «Définition de l'ordre des obligations et exemples."Thoughtco, nov. 5, 2019, disponible ici.
Image gracieuseté:
1. «Diagramme de multiplicité de spin» par LlightEx - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


