Différence entre monatomique et diatomique
Le différence clé entre monatomique et diatomique est que le Les espèces monatomiques ont un atome tandis que les espèces diatomiques ont deux atomes.
Par conséquent, la différence entre monatomique et diatomique est principalement en ce qui concerne les atomes présents dans l'espèce. Comme les noms le suggèrent, ces deux termes représentent différents états d'associations atomiques où «mono» signifie «un» et «di» signifie «deux."Par conséquent, simplement, monatomique signifie un"un atomeet des moyens diatomiques 'deux atomes.'
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que monatomique
3. Qu'est-ce que diatomique
4. Comparaison côte à côte - monatomique vs diatomique sous forme tabulaire
5. Résumé
Qu'est-ce que monatomique?
Quand un seul atome existe seul (ce qui est rarement le cas), nous l'appelons monatomique. Cela signifie que les éléments sont dans leur forme singulière pure. Cependant, le seul exemple pratique qui peut faire partie de cette catégorie est les gaz nobles qui existent en tant qu'atomes par eux-mêmes car ils ont leur coquille extérieure avec un octet complet d'électrons. Par conséquent, ils ne cherchent pas à accepter ou à donner plus d'électrons pour être plus stables. Par conséquent, les gaz nobles sont stables sous forme monatomique. Certains exemples sont; He - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
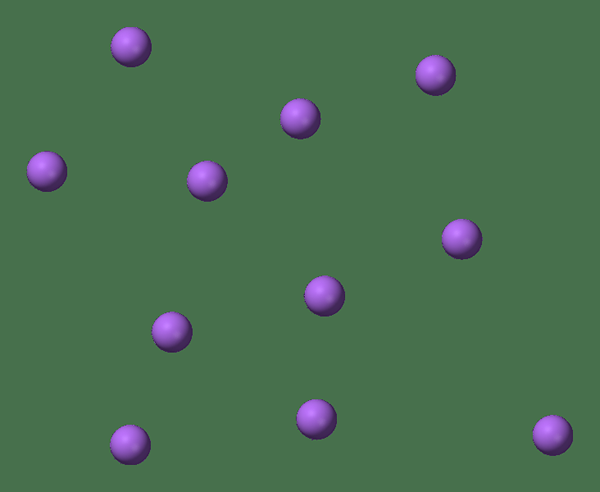
Figure 01: signifie monatomique avoir des atomes uniques
De plus, il existe également des atomes uniques sous des formes ioniques, en particulier dans les solutions, et certains exemples sont; N / A+, Californie2+, K+ etc. Ces ions ont une charge fixe sur eux, ce qui signifie qu'ils ont une valence constante. Mais, il existe d'autres types d'ions qui ont de nombreuses valences et peuvent exister sous de nombreuses formes ioniques, toujours monatomique. Un bon exemple est le fer; Fe2+ et Fe3+. Ainsi, non seulement les cations (chargées positivement), mais les anions (chargés négativement) existent également sous forme monatomique; CL-, F-, je- sont quelques exemples qui existent sous forme monatomique. Ces espèces ioniques ne sont pas stables seules et chercheraient naturellement des homologues pour former des composés.
Mais, comme mentionné ci-dessus, nous pouvons les trouver dans des solutions sur l'hydrolyse de leurs composés. Les espèces ioniques se forment en raison du manque de stabilité de l'atome unique sous une forme pure qui est incapable d'atteindre la configuration électronique noble à gaz. Par conséquent, ces atomes acceptent ou donnent des électrons afin de gagner la stabilité.
Qu'est-ce que diatomique?
Quand Deux atomes sont associés les uns aux autres, Nous l'appelons diatomique. Ces atomes peuvent se produire comme le même type ou différent. Quand ce sont deux atomes similaires en association, nous l'appelons 'diatomées homonucléaires'Et s'ils se composent de différents types, nous l'appelons'diatomées hétéronucléaires'. Des exemples de quelques diatomées homonucléaires seraient o2, N2, H2, etc. Alors que co, non, HCl, etc. peut être donné comme exemples pour les diatomées hétéronucléaires.

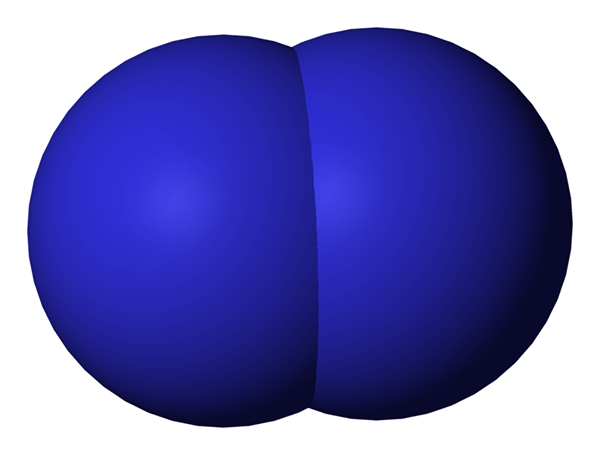
Figure 02: Diatomic signifie avoir deux atomes
Nous pouvons considérer les diatomées comme des composés car ils forment ces associations afin d'atteindre plus de stabilité en partageant des électrons les uns avec les autres afin que les deux atomes atteignent la configuration électronique noble à gaz. Ils peuvent se lier à travers des liaisons covalentes par le chevauchement des orbitales atomiques, sinon ils peuvent former des liaisons ioniques entre eux, qui est une force d'attraction entre une espèce cation (chargée positivement) et une espèce anion (chargée négativement). Des exemples de liaisons covalentes parmi les diatomées comprennent le CO, le NO, etc. Et nous considérons HCL comme une espèce avec un caractère d'attraction ionique. Cependant, comme la force d'attraction entre h+ et cl- n'est pas très fort, ce n'est pas un très bon exemple pour les liens ioniques qui est un autre sujet défini.
Quelle est la différence entre monatomique et diatomique?
Le terme monatomique fait référence à la présence d'un atome tandis que le terme diatomique fait référence à la présence de deux atomes en association. Par conséquent, la principale différence entre monatomique et diatomique est que les espèces monatomiques ont un atome tandis que les espèces diatomiques ont deux atomes. De plus, une autre différence entre monatomique et diatomique est que les espèces monatomiques sont généralement instables à l'exception des gaz nobles tandis que les espèces diatomiques sont généralement stables car il existe une liaison chimique entre les deux atomes qui se forment afin de compléter l'octet électronique autour de chaque atome.
L'infographie ci-dessous montre la différence entre monatomique et diatomique sous forme tabulaire.

Résumé - monatomique vs diatomique
Les deux termes monatomiques et diatomiques décrivent le nombre d'atomes présents dans une espèce chimique. Par conséquent, la principale différence entre monatomique et diatomique est que les espèces monatomiques ont un atome tandis que les espèces diatomiques ont deux atomes.
Référence:
1. «Gas monatomique.»Wikipedia, Wikimedia Foundation, 17 septembre. 2018. Disponible ici
Image gracieuseté:
1.«Monatomic-Sodium-Gas-3D-VDW» par Benjah-Bmm27 - Propre travaux, (domaine public) via Commons Wikimedia
2.«Dinitrogen-3D-VDW» (domaine public) via Commons Wikimedia


