Différence entre l'ionisation et la dissociation
Différence clé - ionisation vs dissociation
L'ionisation et la dissociation sont deux processus importants en chimie. L'ionisation et la dissociation sont souvent confuses, en particulier dans le cas de la dissolution des composés ioniques. On pourrait penser que la dissolution des composés ioniques entraîne une ionisation depuis que les composés ioniques se dissolvent dans l'eau, produisant des particules ou des ions chargés. Mais c'est un exemple de dissociation car les composés ioniques sont déjà fabriqués à partir d'ions. Par conséquent, la principale différence entre l'ionisation et la dissociation est que L'ionisation est la production de nouveaux ions par gain ou perte d'électron alors que La dissociation est la division ou la séparation des ions qui existent déjà dans un composé.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'ionisation
3. Qu'est-ce que la dissociation
4. Comparaison côte à côte - ionisation vs dissociation
5. Résumé
Qu'est-ce que l'ionisation?
L'ionisation est le processus qui produit un atome chargé ou une molécule par gain ou perte d'un électron. Ce processus produit une particule chargée. Dans ce processus, les atomes électriquement neutres deviennent des particules chargées électriquement. Cette charge peut être positive ou négative. Qui dépend du gain ou de la perte d'un électron. Si un atome ou une molécule perd un électron, il deviendra positivement chargé alors que s'il gagne un électron de l'extérieur, il deviendra négativement chargé. Le processus d'ionisation est généralement irréversible, ce qui signifie que si un atome ou une molécule gagne un électron, il ne relâche pas cet électron; Si un atome perd un électron, il ne ramènera pas un électron. Cela se produit lorsque la perte ou le gain de cet électron provoque un ion stable, qui obéit à la règle des octets.
Parfois, le terme ionisation est confondu avec la dissociation. Si un composé ionique tel que le chlorure de sodium (NaCl) est considéré, il formera des ions lorsqu'il est dissous dans l'eau. Bien que cela forme des ions, ce n'est pas l'ionisation. Étant donné que le NaCl solide est divisé en ses ions ou que leurs liaisons ioniques sont brisées, il ne peut pas être appelé ionisation. Ainsi, la scission d'une liaison ionique n'est pas un processus d'ionisation car un électron a déjà donné à un atome par l'autre atome et seule une attraction électrostatique existe. Par conséquent, on peut dire que les composés ayant des obligations ioniques ne participent pas à l'ionisation. Bien que les composés ioniques ne puissent pas subir une ionisation, les composés covalents ayant des liaisons covalentes entre les atomes peuvent subir un processus d'ionisation. En effet. Mais l'ionisation ne se produit que dans des composés covalents polaires ayant des atomes avec une différence considérable d'électronégativité. Sinon, l'ionisation ne se produira pas en raison d'une forte liaison covalente. L'ionisation se déroule également dans les métaux. Là, les ions métalliques chargés positivement sont produits en libérant des électrons à partir d'atomes métalliques.
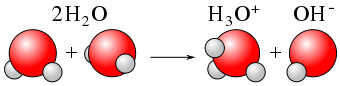
Figure 01: Ionisation
Qu'est-ce que la dissociation?
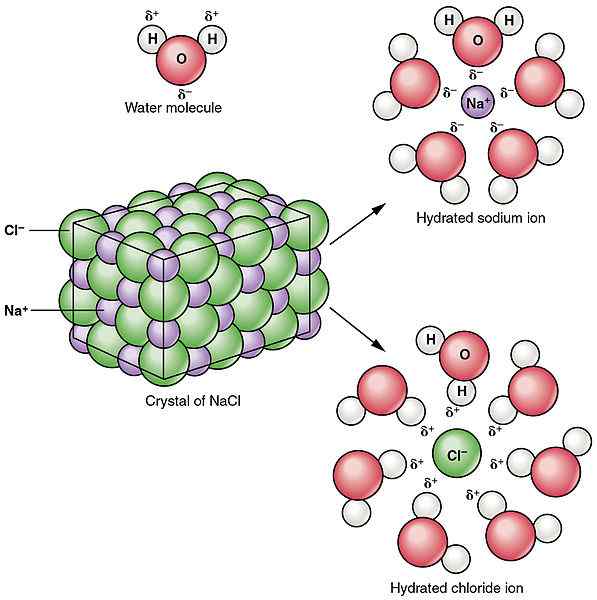
La dissociation se réfère à la rupture ou à la division d'un composé en particules plus petites. Le processus de dissociation peut entraîner des produits chargés électriquement ou neutres. Cela n'implique pas le gain ou la perte d'électrons par les atomes. Contrairement au processus d'ionisation, la dissociation est la séparation des ions qui existaient déjà dans un composé. Parfois, la dissociation peut également produire des particules neutres. Par exemple, la ventilation de n2O4 entraîne la production de deux molécules de non2. Les processus de dissociation sont réversibles la plupart du temps. Cela signifie que les ions séparés peuvent être réorganisés pour produire le composé précédent. Par exemple, comme mentionné ci-dessus, la dissolution du NaCl est un processus de dissociation et il produit deux particules chargées. Mais, le NaCl solide peut être obtenu à nouveau avec des conditions appropriées données, ce qui prouve que la dissociation est réversible. Contrairement à l'ionisation, la dissociation se déroule dans les composés ioniques.

Figure 02: Dissociation du chlorure de sodium dans l'eau
Quelle est la différence entre l'ionisation et la dissociation?
Ionisation vs dissociation | |
| L'ionisation est le processus qui produit de nouvelles particules chargées. | La dissociation est la séparation des particules chargées qui existent déjà dans un composé. |
| Composé initial | |
| L'ionisation implique des composés ou des métaux covalents polaires | La dissociation implique des composés ioniques. |
| Produit | |
| L'ionisation produit toujours des particules chargées | La dissociation produit des particules chargées ou des particules électriquement neutres. |
| Processus | |
| Le processus d'ionisation est irréversible. | La dissociation est réversible. |
| Obligations | |
| L'ionisation implique des liaisons covalentes entre les atomes | La dissociation implique des liaisons ioniques dans des composés. |
Résumé - ionisation vs dissociation
L'ionisation et la dissociation sont deux processus différents. Par conséquent, il est très important de comprendre la différence entre ces deux processus. La principale différence entre l'ionisation et la dissociation est que la dissociation est le processus de séparation des particules chargées qui existaient déjà dans le composé tandis que l'ionisation est la formation de nouvelles particules chargées qui étaient absentes dans le composé précédent.
Les références:
1. Hamza, s. UN., 2014. Part de diapositive. [En ligne] Disponible sur: https: // www.diaporama.net / sheikhamirhamza / dssociation-vs-ionisationppt [consulté 29 05 2017].
2. Chang, R., 2010. Chimie. 10e édition. New York: McGraw-Hill.
Image gracieuseté:
1. «214 Dissociation du chlorure de sodium dans Water-01» par OpenStax College - Anatomy & Physiology, Connexions Web Site. 19 juin 2013. (CC par 3.0) via Commons Wikimedia
2. «Autoprotolyse Eau» de CDang - Propre travaux (domaine public) via Commons Wikimedia


