Différence entre les électrodes actives et inertes
Différence clé - Electrodes actifs vs inertes
Une cellule électrochimique est composée de deux conducteurs électriques appelés électrodes et un conducteur ionique appelé électrolyte. Les électrodes transportent la charge électrique à travers les électrons tandis que les électrolytes conduisent leur charge à travers des ions. Une électrode est un métal dont la surface touche l'électrolyte. L'électrolyte est un composant non métallique qui peut être une solution ou un vide. Les composés ioniques ne peuvent pas conduire de l'électricité sous leur forme solide. Ainsi, ils devraient être sous forme liquide afin de conduire l'électricité. Ces formes liquides sont les électrolytes qui ont été mentionnés précédemment. Sur les deux électrodes, on agit comme la cathode (chargée négativement) et d'autres agissent comme l'anode (chargée positivement). Les électrodes sont principalement de deux types, à savoir les électrodes actives et les électrodes inertes. La différence clé entre l'électrode active et l'électrode inerte est que L'électrode active participe à la réaction chimique alors que jeL'électrode NERT ne participe pas ou n'interfère pas avec la réaction chimique.
CONTENU
1. Aperçu et différence clé
2. Que sont les électrodes actives
3. Que sont les électrodes inertes
4. Comparaison côte à côte - électrodes actives vs inertes
5. Résumé
Qu'est-ce qu'une électrode active?
L'électrode active est un métal utilisé dans les cellules électrochimiques. Il participe à des réactions qui se produisent dans l'électrolyte afin de transporter l'électricité. L'électrode active peut être oxydée ou réduite. Les électrodes actives sont principalement utilisées dans l'électroples. L'électroplastie est le processus où un métal est appliqué sur un autre métal avec l'utilisation d'une cellule électrochimique. Là, l'électrode active agit comme l'anode qui fournit les cations à la solution électrolytique. Ensuite, les cations atteindront la cathode et prendront les électrons disponibles là-bas. Cela provoque le dépôt d'ions métalliques à la surface de la cathode. Par conséquent, le matériau qui doit être étalé par cette méthode est utilisé comme cathode. Par exemple, une cuillère peut être plaquée en argent en utilisant une anode argentée et la cuillère comme cathode; Le nitrate d'argent serait l'électrolyte.
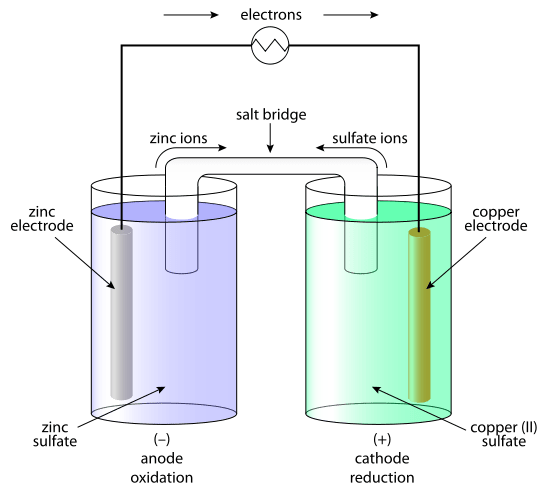
Fondamentalement, l'électrode active est appelée «active» car elle participe activement à la réaction chimique qui se produit dans le système. Par conséquent, il échange activement des ions avec une solution électrolytique. Une électrode active la plus couramment utilisée est l'électrode en cuivre.

Figure 01: L'électrode en cuivre est un exemple d'électrode active.
Qu'est-ce qu'une électrode inerte?
L'électrode inerte est un métal qui ne participe pas ou n'interfère pas dans une réaction chimique. Mais il est toujours utilisé pour conduiser l'électricité en transférant des électrons avec la solution plutôt que d'échanger des ions avec la solution. Par conséquent, il sert d'électron. Le platine est utilisé comme électrode inerte. Mais le graphite est largement utilisé parce qu'il est bon marché. L'électrode inerte peut fournir ou retirer des électrons en train de conduire de l'électricité. Les électrodes inertes sont toujours utilisées en électrolyse, le processus qui sépare un composé ionique en ses éléments. Par exemple, l'électrolyse de la solution de chlorure de sodium produit du sodium et du chlore séparément.
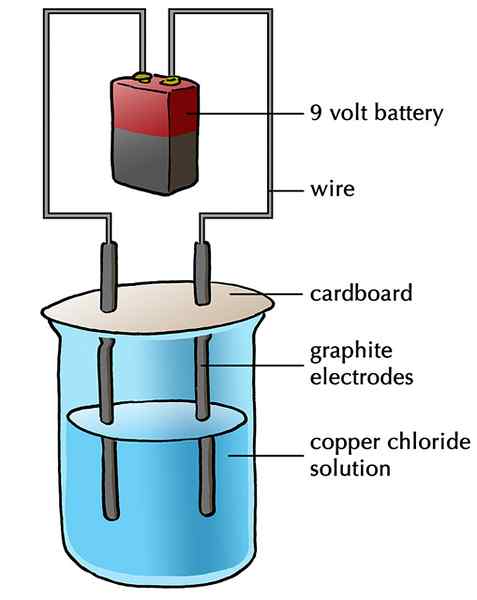
Figure 02: L'électrode en graphite est un exemple d'électrode inerte.
Quelle est la différence entre les électrodes actives et inertes?
Electrodes actives vs inertes | |
| L'électrode active est l'électrode qui participe activement à la réaction chimique de la cellule électrochimique. | L'électrode inerte est une électrode qui ne participe pas à la réaction chimique. |
| Les usages | |
| Les électrodes actives sont utilisées dans l'électroplaste | Des électrodes inertes sont utilisées en électrolyse. |
| Comportement | |
| Les ions métalliques d'électrode active sont dissous dans la solution électrolytique | Les ions métalliques de l'électrode inerte ne sont pas dissous. |
| Réactions | |
| Des réactions d'oxydation ou de réduction peuvent se produire sur une électrode active | Les réactions d'oxydation ou de réduction ne se produisent pas. |
| Mode de conductance électrique | |
| Les électrodes actives conduisent l'électricité par l'échange d'ions | Les électrodes inertes conduisent l'électricité par transfert d'électrons. |
Résumé - Electrodes actifs vs inertes
Les cellules électrochimiques sont capables de générer de l'énergie électrique ou de faciliter l'électricité en participant à des réactions chimiques. Les composants de base d'une cellule électrochimique sont deux électrodes et un électrolyte. Deux électrodes sont nommées comme anode et cathode selon leur comportement. Les électrodes actives et inertes sont les deux types d'électrodes. La principale différence entre l'électrode active et inerte est que l'électrode active participe à la réaction chimique tandis que l'électrode inerte ne participe pas ou n'interfère pas avec la réaction chimique.
Les références:
1. Mittal, V., 2015. LibreTexts. [En ligne] Disponible sur: https: // chem.LibreTexts.org / core / analytical_chemistry / electrochimie / electrolytic_cells / électroplate # title [consulté 26 05 2017].
2.Chang, R., 2010. chimie. 10e édition. Newyork: McGraw-Hill.
Image gracieuseté:
1.«Cellule galvanique étiquetée» par Hazmat2 - propre travail (CC par 3.0) via Commons Wikimedia
2. «Électrolyse de la solution de chlorure de cuivre» par Siyavula Education (CC par 2.0) via Flickr


