Différence entre octet et duplet
Différence clé - OCTET VS DUPLET
Il existe des atomes ou des composés chimiquement actifs et inactifs présents dans la nature. Cette caractéristique dépend principalement du nombre d'électrons présents dans les coquilles les plus externes des atomes. Les atomes ayant des coquilles incomplètes peuvent devenir actifs afin de terminer leur configuration d'électrons pour devenir stable. Les atomes inactifs ont une configuration d'électrons complète; Ainsi, ces atomes ne réagissent avec aucun autre atome à moins que dans des conditions spéciales. Les gaz nobles sont toujours de nature inactive. Par conséquent, ils sont connus comme des gaz inertes. Les gaz inertes sont dans la huitième colonne dans le tableau périodique. D'autres éléments de la même période (ligne) ont tendance à obtenir la configuration électronique du gaz inerte à la fin de cette période, qui est la forme la plus stable dans la nature. Les atomes actifs ont tendance à terminer le nombre d'électrons en fonction de Règle d'octet ou règle duplet. La principale différence entre octet et duplet est que L'octet est un atome ou un ion ayant un maximum de huit électrons dans la coque la plus externe alors que Duplet est un atome ayant le maximum de deux électrons dans la coque à l'extérieur.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'un octet
3. Qu'est-ce qu'un duplet
4. Comparaison côte à côte - octet vs duplet
5. Résumé
Qu'est-ce qu'un octet?
Un octet est un atome ou un ion ayant huit électrons dans la coquille la plus externe de cet atome. Tous les gaz nobles sauf l'hélium ont huit électrons et sont de nature inerte. La configuration électronique d'un gaz noble se terminera toujours comme suit.
ns2 NP6
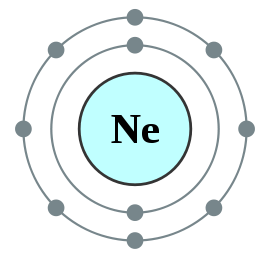
Par exemple, la configuration électronique du néon est 122s22p6 . Le néon est un gaz inerte.
Autres éléments ayant sept, six, etc. Les électrons dans l'orbitale la plus externe ont tendance à obéir à la règle des octets en obtenant des électrons de l'extérieur; Quelques autres éléments en ayant un, deux, etc. Les électrons ont tendance à perdre des électrons et à obtenir la configuration d'électrons du gaz inerte le plus proche. Mais d'autres éléments au milieu du tableau périodique formeront de nouvelles liaisons avec des éléments ayant un excès d'électrons pour partager ces électrons et devenir un octet.
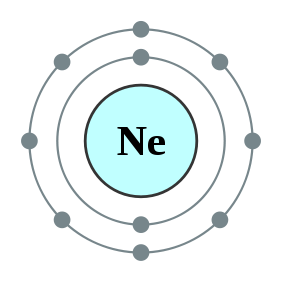
Figure 01: Neon, un octet
Qu'est-ce qu'un duplet?
L'atome d'hydrogène et l'atome d'hélium sont les plus petits éléments de nature et n'ont qu'une seule orbitale autour de leur noyau. Cette orbitale est appelée 1s orbitale. Cette orbitale peut contenir un maximum de deux électrons. L'atome d'hydrogène a un électron et l'hélium a deux électrons. Par conséquent, l'hélium est appelé duplet. L'hélium a le nombre maximal d'électrons qu'il peut avoir; C'est donc un élément stable dans la nature. Par conséquent, l'hélium est également un gaz inerte. Mais l'hydrogène n'a qu'un seul électron et la seule orbitale qu'elle a est incomplète. Ainsi, l'atome d'hydrogène seul est très réactif et il a tendance à former une liaison covalente avec un autre atome d'hydrogène en partageant les seuls électrons qu'ils ont. Ensuite, ces atomes d'hydrogène deviennent des duplets car ils ont maintenant deux électrons dans leurs orbitales les plus externes. Mais le lithium peut également se comporter comme un duplet en retirant l'électron de son orbitale la plus externe. La configuration électronique du lithium est 122s1. En supprimant les 21 électron, il peut devenir un duplet. Dans ce cas, lui, h- et li+ sont des duplets qui peuvent exister sous forme de duplets stables.
Tous les duplets ont la configuration d'électrons se terminant comme suit.
ns2

Figure 02: Helium, un duplet
Quelle est la différence entre octet et duplet?
Octet vs duplet | |
| L'octet a huit électrons dans la coque la plus à l'extérieur. | Duplet a deux électrons dans la coque la plus externe. |
| Configuration d'électrons commune | |
| Octet a ns2 NP6 Tapez la configuration d'électrons à la fin. | Duplet a NS2 Tapez la configuration à la fin. |
| Nombre d'orbitales | |
| Octet peut avoir un minimum de deux orbitales. | Un duplet n'a qu'une seule orbitale. |
| Type d'orbitales | |
| Un octet peut avoir tous les types d'orbitales tels que S, P, D, F, etc. | Duplet n'a que S orbital. |
Résumé - OCTET VS DUPLET
Tous les éléments ont tendance à devenir stables. Mais avec des configurations d'électrons incomplètes, les atomes ne peuvent pas être stables; Ainsi, ils deviennent très réactifs afin de remplir les coquilles d'électrons en gagnant, en perdant ou en partageant des électrons. Les atomes ou les molécules qui obéissent à la règle des octets ou du duplet sont stables. La principale différence entre octet et duplet est qu'octet a huit électrons dans son orbitale la plus externe alors que Duplet a deux électrons dans son orbitale.
Les références:
1. NEMA, P., 2011. Topperlearning. [En ligne] Disponible sur: http: // www.topperlearning.com / forums / home-work-help-19 / what-is-oct-duplet-valency-and-ions-chimistry-structure-of-the-atom-46317 / réponse [consulté 29 05 2017].
2.Chang, R., 2010. Chimie. 10e édition. New York: McGraw-Hill.
3.Anon., 2015. Stacker de qualité. [En ligne] Disponible sur: http: // Gradestack.com / NTSE-COMPLET Course / Chemical-Bonding / Chemical-Activity-of-AN / 19176-3853-37737-study-wtw [Consulté 29 05 2017].
Image gracieuseté:
1. «Electron Shell 002 Helium - No Label» de Pumbaa (travail original de Greg Robson) - Diagrammes de coque électronique (version étiquetée correspondante) (CC BY-SA 2.0 UK) via Commons Wikimedia
2. «Electron Shell 010 Neon» par Pumbaa (travail original de Greg Robson) (CC BY-SA 2.0 UK) via Commons Wikimedia


