Différence entre redox intramoléculaire et réaction redox disproportionnée
Le différence clé Entre redox intramoléculaire et la réaction redox disproportionnée est que Les réactions redox intramoléculaires se produisent lorsqu'une seule molécule subit une oxydation et une réduction du même élément chimique ou des éléments chimiques différents tandis que les réactions redox disproportionnées impliquent l'oxydation et la réduction du même élément chimique dans un seul substrat.
Les réactions redox intramoléculaires et les réactions redox disproportionnées sont deux types de réactions chimiques inorganiques où les réactions d'oxydation et de réduction se produisent parallèles les unes aux autres. Ces deux réactions chimiques impliquent la demi-réaction d'oxydation et de réduction survenant dans le même composé chimique / dans une seule molécule de substrat. Les deux types diffèrent les uns des autres selon l'élément chimique dans lequel ces demi-réactions ont lieu.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions redox intramoléculaires
3. Quelles sont les réactions redox disproportionnées
4. Comparaison côte à côte - Redox intramoléculaire vs réaction redox disproportionnée sous forme tabulaire
5. Résumé
Quelles sont les réactions redox intramoléculaires?
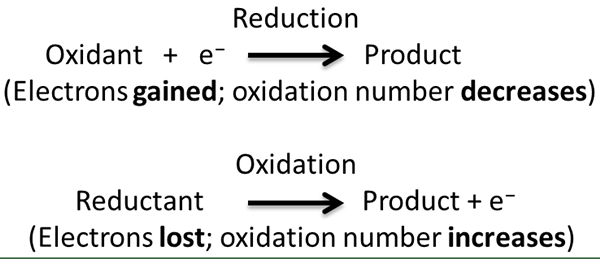
Les réactions redox intramoléculaires sont des réactions chimiques qui impliquent un seul substrat où l'oxydation et la réduction se produisent dans le même élément chimique ou dans deux éléments chimiques différents. En d'autres termes, dans certaines réactions redox intramoléculaires, l'oxydation et la réduction se produisent dans le même élément chimique tandis que dans d'autres réactions redox intramoléculaires, l'oxydation et la réduction se produisent en deux éléments chimiques différents qui sont dans la même molécule. Si l'oxydation et la réduction se produisent dans le même élément chimique, alors nous l'appelons comme disproportionnée.

Figure 01: Processus chimique d'une réaction redox
Quelles sont les réactions redox disproportionnées?
Les réactions redox disproportionnées sont des réactions chimiques où l'oxydation et la réduction se produisent dans le même élément chimique d'une seule molécule de substrat. Dans ce type de réactions, une seule molécule de substrat fonctionne dans les deux sens, oxydant et réduisant les demi-réactions. Ici, une partie de la molécule subit une oxydation tandis que l'autre partie de la molécule subit une réduction; Cependant, ces deux parties moléculaires impliquent le même élément chimique dans lequel l'oxydation ou la réduction se produit. Un exemple est le suivant:
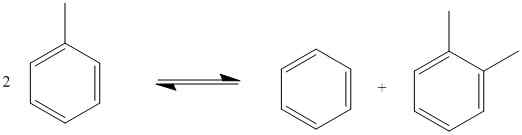
Figure 02: Un exemple de réaction redox disproportionnée
Un autre exemple courant de ce type de réactions chimiques est la disproportionnement de l'atome d'oxygène dans le peroxyde d'hydrogène, la molécule H2O2. Ici, l'oxygène dans la molécule de peroxyde d'hydrogène subit une oxydation pour former l'oxygène gazeux, et la même molécule subit une réduction pour former une molécule d'eau.
Quelle est la différence entre redox intramoléculaire et réaction redox disproportionnée?
Les réactions redox sont des réactions chimiques dans lesquelles une demi-réaction d'oxydation et une demi-réaction de réduction se produisent parallèles les unes aux autres. La principale différence entre le redox intramoléculaire et la réaction redox disproportionnée est que les réactions redox intramoléculaires se produisent lorsque des molécules de deux substances différentes réagissent entre elles, tandis que les réactions redox disproportionnées impliquent l'oxydation et la réduction d'une seule molécule.
Disproporation de c6H2(NON2)3Ch3 pour former n2 via la réduction et C via l'oxydation est un exemple de réaction redox intramoléculaire tandis que la disproportionnement de l'atome d'oxygène dans une molécule de peroxyde d'hydrogène est un exemple de réaction redox disproportionnée.
L'infographie ci-dessous résume les différences entre redox intramoléculaire et réaction redox disproportionnée sous forme tabulaire pour comparaison côte à côte.

Résumé - Redox intramoléculaire vs réaction redox disproportionnée
Les réactions redox sont des réactions chimiques impliquant des réactions d'oxydation et de réduction qui se produisent parallèles les unes aux autres. La principale différence entre le redox intramoléculaire et la réaction redox disproportionnée est que les réactions redox intramoléculaires se produisent lorsque des molécules de deux substances différentes réagissent entre elles, tandis que les réactions redox disproportionnées impliquent l'oxydation et la réduction d'une seule molécule.
Référence:
1. Mott, Valerie. «Types de réactions redox." Lumen - Introduction à la chimie, Disponible ici.
2. Helmenstine, Anne Marie. «La définition de la disproportionnement en chimie." Thoughtco, Disponible ici.


