Différence entre les radicaux électropositifs et électronégatifs
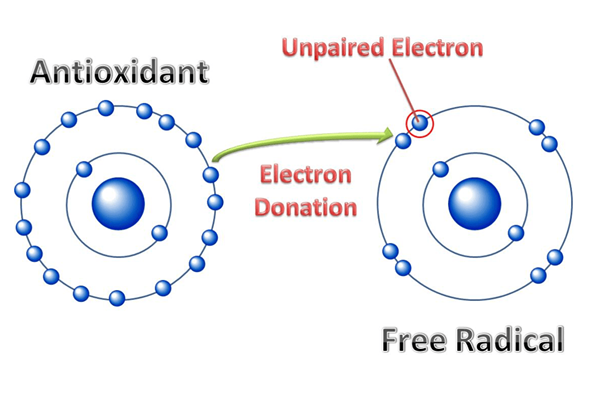
Le différence clé entre les radicaux électropositifs et électronégatifs est que Les radicaux électropositifs sont des composés radicaux ayant la capacité de perdre des électrons et de transporter une charge positive tandis que les radicaux électronégatifs sont des composés radicaux ayant la capacité de gagner des électrons et de porter une charge négative.
Un radical, en chimie, est un atome, une molécule ou un ion qui contient un électron de valence non apparié. Dans la plupart des cas, cet électron unique non apparié rend un composé chimique hautement réactif car cet électron a tendance à s'associer à un autre électron pour obtenir un niveau d'énergie à faible teneur. De plus, un atome, un ion ou une molécule ayant une coque d'électrons ouverte capable d'obtenir des électrons est également classé comme un radical en chimie. En raison de la nature hautement réactive, ces radicaux ont souvent tendance à subir des réactions de dimérisation et de polymérisation.
CONTENU
1. Aperçu et différence clé
2. Que sont les radicaux électropositifs
3. Quels sont les radicaux électronégatifs
4. Comparaison côte à côte - radicaux électropositifs vs électronégatifs sous forme tabulaire
5. Résumé
Que sont les radicaux électropositifs?
Les radicaux électropositifs sont des atomes, des ions ou des molécules qui peuvent perdre un électron et porter une charge électrique positive. Un radical électropositif est formé en raison de la nature électropositive d'une espèce chimique, ce qui signifie qu'une espèce chimique particulière a tendance à perdre des électrons afin de former des radicaux positifs. De plus, certains exemples de radicaux électropositifs incluent le cation calcique (CA+2), cation sodium (na+), etc.

Figure 01: Formation d'un radical
Quels sont les radicaux électronégatifs?
Les radicaux électronégatifs sont des atomes, des ions ou des molécules qui peuvent gagner un électron et transporter une charge électrique négative. Un radical électronégatif est formé en raison de l'électronégativité élevée d'une espèce chimique, ce qui signifie, une espèce chimique particulière a tendance à gagner des électrons et à former des radicaux chargés négativement.
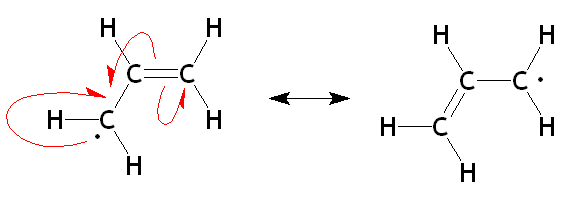
Figure 02: Résonance dans les radicaux
De plus, certains exemples de radicaux électronégatifs incluent l'anion chlore (CL-), anion fluorure (f-), etc.
Quelle est la différence entre les radicaux électropositifs et électronégatifs?
Les radicaux sont des espèces chimiques telles que des atomes, des ions ou des molécules ayant un électron non apparié. La principale différence entre les radicaux électropositifs et électronégatifs est que les radicaux électropositifs sont des composés radicaux ayant la capacité des électrons et transportent une charge positive tandis que les radicaux électronégatifs sont des composés radicaux ayant la capacité de gagner des électrons et d'emporter une charge négative. Par conséquent, les radicaux électropositifs portent une charge positive tandis que les radicaux électronégatifs portent une charge négative. Certains exemples de radicaux électropositifs comprennent le cation calcique et le cation sodium tandis que les exemples de radicaux électronégatifs comprennent le fluor et les ions chlorure.
Le tableau suivant résume la différence entre les radicaux électropositifs et électronégatifs.

Résumé - Radicaux électropositifs vs électronégatifs
Un radical, en chimie, est un atome, une molécule ou un ion qui contient un électron de valence non apparié. La principale différence entre les radicaux électropositifs et électronégatifs est que les radicaux électropositifs sont des composés radicaux ayant la capacité de perdre des électrons et de transporter une charge positive tandis que les radicaux électronégatifs sont des composés radicaux ayant la capacité de gagner des électrons et d'emporter une charge négative. La plupart du temps, les radicaux sont des espèces chimiques très réactives qui les font subir des réactions de dimérisation et de polymérisation.
Référence:
1. Plus, Hemant. «Nommer des composés chimiques: radicaux, ions, acides, bases, sels, etc." Le facteur de fait, 5 juin 2020, disponible ici.
2. «Électronégativité." Wikipédia, Fondation Wikimedia, 24 octobre. 2020, disponible ici.
3. «Qu'est-ce que l'électropositivty? Définition, tendances, comparaison avec l'électronégativité.”ByJus, Byju's, 17 août. 2020, disponible ici.
Image gracieuseté:
1. «Radicaux libres antioxydants Lobo et al.,”Par Lobo, V., Patil, un., Phatak, un., & Chandra, n - lobo, v., Patil, un., Phatak, un., & Chandra, n. (2010). Radicaux libres, antioxydants et aliments fonctionnels: impact sur la santé humaine. Revues de pharmacognosie, 4 (8), 118-126. (CC BY-SA 4.0) via Commons Wikimedia
2. «Allyl Radical Resonance» par Orgonaute - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia


