Différence entre l'IGA et l'IgG
Différence clé - Iga vs IgG
Les immunoglobulines sont appelées type spécial de protéines globulaires avec une structure complexe. Ils sont produits par le système vivant comme une réponse immunitaire spécifique au secondaire lors de la contact avec un antigène d'une particule étrangère ou d'un organisme. Les immunoglobulines sont également appelées anticorps qui sont des protéines spécifiques produites en réponse à un antigène. Les cinq principales classes d'anticorps sont - Immunoglobulin (Ig) A, G, M, E, D. L'immunoglobuline A (IgA / IgG) est une immunoglobuline sécrétoire présente dans les surfaces muqueuses, composée d'une chaîne J et d'un polypeptide sécrétoire qui participe à la fonction sécrétoire. L'immunoglobuline G (IgG / IgG) est principalement impliquée dans l'action contre les agents pathogènes étrangers qui incluent les bactéries et le virus. Le différence clé Entre l'IGA et l'IgG est la présence et l'absence du polypeptide sécrétoire. L'IGA a un polypeptide sécrétoire pour faciliter la sécrétion via des surfaces muqueuses alors que l'IgG n'a pas de fonction sécrétoire ainsi, la chaîne J est absente.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que Iga
3. Qu'est-ce que l'IgG
4. Similitudes entre IgA et IgG
5. Comparaison côte à côte - Iga vs IgG sous forme tabulaire
6. Résumé
Qu'est-ce que Iga?
L'IGA est un type d'immunoglobuline qui possède une fonction sécrétoire. Par conséquent, l'IGA peut être principalement trouvée dans les sécrétions, notamment la salive et le lait maternel. Environ 50% de la composition protéique du colostrum est IgA. Il est également sécrété par les couches muqueuses du tractus gastro-intestinal et des voies respiratoires. Cela fournit un mécanisme de protection contre les agents pathogènes entrant à l'intestin ou aux voies respiratoires.

Figure 01: Structure de l'IGA
Il y a deux sous-classes principales d'IGA; Iga 1 et iga2. Iga1 Posséder une région de charnière plus longue et a un ensemble supplémentaire d'acides aminés dans sa structure. Cette région de charnière allongée augmente la sensibilité de l'IGA1 aux protéases bactériennes. Par conséquent, il est présent principalement dans le sérum. Iga2 est composé d'une région de charnière plus courte, et il n'a pas la structure en double acide aminé. Par conséquent, il n'a pas de sensibilité accrue à la protéase. L'IGA2 est présente principalement dans les membranes de sécrétion muqueuses.
IgA forme une structure dimère qui est une caractéristique de ce type d'immunoglobuline. Les monomères sont rejoints par une structure connue sous le nom de la chaîne J. La chaîne J est liée à la structure des dimères via des liaisons disulfure. Un polypeptide est associé à la structure du dimère qui agit comme le composant polypeptidique sécrétoire de l'IGA. La fonction principale des IgA est de protéger les couches muqueuses contre les toxines externes et les produits chimiques tels que les toxines bactériennes et virales. L'IGA participe à une réaction neutralisante pour neutraliser les produits de toxine.
Qu'est-ce que l'IgG?
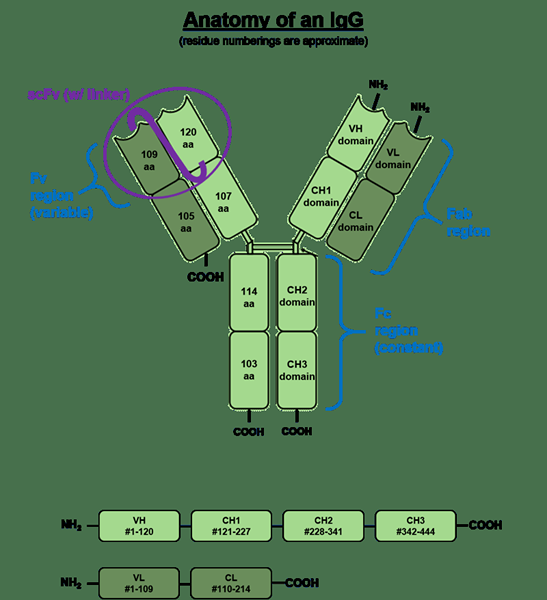
L'IgG est le type d'immunoglobuline le plus courant présent dans le système. C'est aussi la principale forme d'immunoglobuline circulatoire dans le corps. L'IgG est la seule forme d'immunoglobuline qui peut traverser le placenta et atteindre le fœtus. L'IgG se compose de quatre chaînes polypeptidiques; 2 chaînes lourdes et 2 chaînes légères qui sont liées entre elles par des liaisons disulfure de chaîne inter-chaîne. Chaque chaîne lourde se compose d'un domaine variable N-terminal (VH) et de trois domaines constants (CH1, CH2, CH3), avec une «région de charnière» supplémentaire entre CH1 et CH2. Chaque chaîne lumineuse est composée d'un domaine variable N-terminal (VL) et d'un domaine constant (CL). La chaîne légère est associée aux domaines VH et CH1 pour former un bras fabuleux («fab» = liaison à l'antigène des fragments), et les régions V interagissent pour former la région de liaison à l'antigène. D'autres IgG contient également une région hautement conservée qui se compose d'un acide aminé glycosylé au 297e position.

Figure 02: Structure générale de l'IgG
L'IgG a quatre sous-classes majeures à savoir IgG1, IgG2, IgG3 et IgG4. Igg1 est la sous-classe la plus abondante. Il s'agit de la réponse immédiate des anticorps produits dans le corps lors d'une infection par un agent bactérien ou viral. Igg2 sont produits principalement en réponse aux antigènes capsulaires bactériens. Ces anticorps réagissent aux antigènes à base de glucides. Il peut également agir contre les virus qui possèdent des antigènes à base de glucides. Igg3 est un anticorps pro-inflammatoire qui est généralement produit en réponse à une infection virale. Igg3 est le principal anticorps produit en réponse aux antigènes du groupe sanguin. Les anticorps IgG4 sont produits en réponse à des infections prolongées.
Quelles sont les similitudes entre l'IGA et l'IgG?
- Les deux sont produits en raison d'une réponse immunitaire secondaire.
- Les deux sont produits en réponse aux antigènes ou aux marqueurs antigéniques produits en
- Les deux sont très spécifiques.
- Les deux se compose de quatre chaînes polypeptidiques; 2 chaînes lourdes et 2 chaînes légères.
- Les deux participent à la lutte contre les agents pathogènes bactériens et viraux.
Quelle est la différence entre l'IGA et l'IgG?
Iga vs IgG | |
| L'IgA est un anticorps présent dans les sécrétions et les muqueuses et agit contre les agents pathogènes bactériens et viraux. | L'IgG est un anticorps produit comme mécanisme immunitaire secondaire impliqué dans la lutte contre les souches virales et bactériennes pathogènes. |
| Distribution | |
| L'IGA est dans des muqueuses et des sécrétions corporelles telles que la salive et le lait maternel. | L'IgG est dans tous les tissus intra et vasculaires supplémentaires. |
| Composition de la chaîne lourde | |
| Iga a une chaîne lourde alpha. | L'IgG a une chaîne lourde gamma. |
| Concentration en sérum | |
| En sérum, la concentration d'IgA est 0.6 - 3 mg / ml. | En sérum, la concentration d'IgG est de 6 à 13 mg / ml. |
| Chaîne J | |
| Présent dans iga. | Absent dans les IgG. |
| Polypeptide sécrétoire | |
| Présent dans iga. | Absent dans les IgG. |
| Capacité à traverser le placenta | |
| Iga ne peut pas traverser le placenta. | IgG peut traverser le placenta. |
Résumé - IGA vs IgG
L'IGA et l'IgG sont produites dans le corps comme réponse immunitaire secondaire. Ce sont des anticorps spécifiques qui agissent en se liant à un antigène spécifique. La principale différence des deux immunoglobulines est basée sur la fonction de la sécrétion. L'IGA est présente est des fluides sécrétoires et dans des membranes de sécrétion muqueuses tandis que l'IgG est l'immunoglobuline la plus abondante du sérum. Les deux ont la capacité de lutter contre les agents pathogènes microbiens. C'est la différence entre l'IGA et l'IgG.
Téléchargez la version PDF d'IGA vs IgG
Vous pouvez télécharger la version PDF de cet article et l'utiliser à des fins hors ligne selon la note de citation. Veuillez télécharger la version PDF ici différence entre IgA et IgG
Référence:
1.Schroeder, Harry W et Lisa Cavacini. «Structure et fonction des immunoglobulines.»Le Journal of Allergy and Clinical Immunology, U.S. Bibliothèque nationale de médecine, février. 2010. Disponible ici
2.Woof, J M et M W Russell. «Les relations de structure et de fonction dans l'IGA.»Nature News, Nature Publishing Group, 21 septembre. 2011. Disponible ici
3.Janeway, Charles A et Jr. «La structure d'une molécule d'anticorps typique.«Immunobiologie: le système immunitaire en santé et maladie. 5e édition., U.S. Bibliothèque nationale de médecine, 1er janvier. 1970. Disponible ici
Image gracieuseté:
1.'Dimeric Iga Schematic 01.'Par McORTNGHH - Propre travaux, (CC By-SA 4.0) via Commons Wikimedia
2.`` Anatomie d'un IgG 'par W: Utilisateur: Ajvincelli, Domaine public via Commons Wikimedia


