Différence entre la liaison hydrogène et la liaison ionique
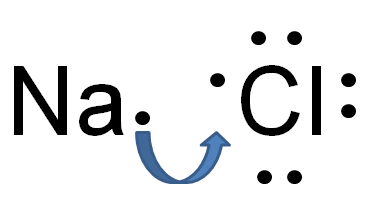
Le différence clé entre la liaison hydrogène et la liaison ionique est Cette liaison ionique existe entre les anions permanents et les cations, tandis que les liaisons hydrogène existent entre les charges partielles et négatives partielles partielles.
Les liaisons chimiques maintiennent ensemble des atomes et des molécules. Les liaisons sont importantes pour déterminer le comportement chimique et physique des molécules et des atomes. Comme proposé par le chimiste américain G.N.Lewis, les atomes sont stables lorsqu'ils contiennent huit électrons dans leur coquille de valence. La plupart des atomes ont moins de huit électrons dans leurs coquilles de valence (à l'exception des gaz nobles dans le groupe 18 du tableau périodique); Par conséquent, ils ne sont pas stables. Ces atomes ont tendance à réagir les uns avec les autres pour devenir stables. Ainsi, chaque atome peut atteindre une configuration électronique à gaz noble. Les liaisons ioniques sont une de ces liaisons chimiques, qui relie les atomes dans les composés chimiques. Les liaisons hydrogène sont des attractions intermoléculaires entre les molécules.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la liaison hydrogène
3. Qu'est-ce que le lien ionique
4. Comparaison côte à côte - liaison hydrogène vs liaison ionique sous forme tabulaire
5. Résumé
Qu'est-ce que la liaison hydrogène?
Lorsque l'hydrogène est attaché à un atome électronégatif comme le fluor, l'oxygène ou l'azote, il créera une liaison polaire. En raison de l'électronégativité, les électrons de la liaison sont plus attirés par l'atome électronégatif que par l'atome d'hydrogène. Par conséquent, l'atome d'hydrogène obtiendra une charge positive partielle, tandis que l'atome plus électronégatif obtiendra une charge négative partielle. Lorsque deux molécules ayant cette séparation de charge sont à proximité, une force d'attraction augmente entre l'hydrogène et l'atome chargé négativement. Nous appelons cette liaison hydrogène.
Les liaisons hydrogène sont relativement plus fortes que les autres interactions dipolaires, et elles déterminent le comportement moléculaire. Par exemple, les molécules d'eau ont une liaison hydrogène intermoléculaire. Une molécule d'eau peut former quatre liaisons hydrogène avec une autre molécule d'eau. Puisque l'oxygène a deux paires solitaires, il peut former deux liaisons hydrogène avec de l'hydrogène chargé positivement. Ensuite, nous pouvons appeler les deux molécules d'eau comme un dimère. Chaque molécule d'eau peut se lier à quatre autres molécules en raison de la capacité de liaison hydrogène. Il en résulte un point d'ébullition plus élevé pour l'eau, même si une molécule d'eau a un faible poids moléculaire. Par conséquent, l'énergie nécessaire pour briser les liaisons hydrogène lorsqu'elles vont à la phase gazeuse est élevée.
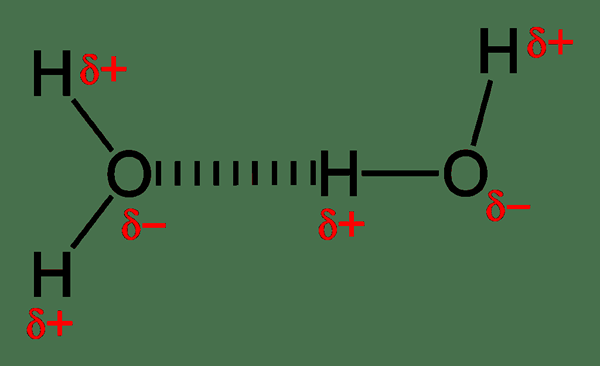
Figure 01: liaisons hydrogène entre les molécules d'eau
De plus, les liaisons hydrogène déterminent la structure cristalline de la glace. La disposition unique de treillis de glace l'aide à flotter sur l'eau; Par conséquent, protégeant la vie aquatique en hiver. En dehors de cela, la liaison hydrogène joue un rôle vital dans les systèmes biologiques. La structure tridimensionnelle des protéines et de l'ADN est uniquement basée sur les liaisons hydrogène. De plus, les liaisons hydrogène peuvent être détruites par le chauffage et les forces mécaniques.
Qu'est-ce que le lien ionique?
Les atomes peuvent gagner ou perdre des électrons et former des particules chargées négatives ou positives, respectivement. Ces particules sont appelées ions. Il y a des interactions électrostatiques entre les ions. Le lien ionique est la force d'attraction entre ces ions chargés de facturation. La force des interactions électrostatiques est largement influencée par les valeurs d'électronégativité des atomes dans une liaison ionique. L'électronégativité donne une mesure de l'affinité des atomes pour les électrons. Un atome à haute électronégativité peut attirer des électrons d'un atome à faible électronégativité pour former une liaison ionique.
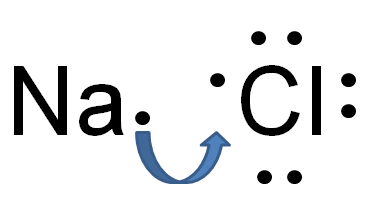
Figure 02: Formation de liaison ionique dans le chlorure de sodium
Par exemple, le chlorure de sodium a une liaison ionique entre l'ion sodium et l'ion chlorure. Le sodium est un métal; Par conséquent, il a une électronégativité très faible (0.9) par rapport au chlore (3.0). En raison de cette différence d'électronégativité, le chlore peut attirer un électron de sodium et former des ions Cl et Na +. Pour cette raison, les deux atomes gagnent la configuration électronique à gaz noble stable. Cl- et Na + sont maintenus ensemble par des forces électrostatiques très fortes attrayantes, formant ainsi une liaison ionique.
Quelle est la différence entre la liaison hydrogène et la liaison ionique?
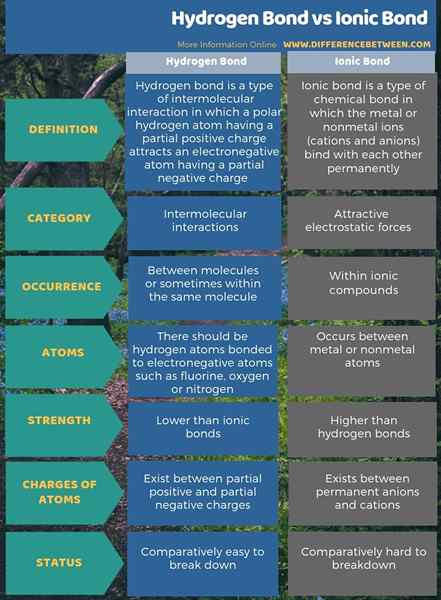
Les liaisons hydrogène sont des attractions intermoléculaires tandis que les liaisons ioniques sont des forces électrostatiques attrayantes. La principale différence entre la liaison hydrogène et la liaison ionique est que la liaison ionique existe entre les anions permanents et les cations, tandis que les liaisons hydrogène existent entre les charges positives partielles et négatives partielles. De plus, les liaisons ioniques sont plus fortes que les liaisons hydrogène.
De plus, les liaisons hydrogène se produisent lorsqu'il y a un atome d'hydrogène et un atome électronégatif tandis que les liaisons ioniques se produisent entre tout atome métallique et non métallique. Il s'agit donc d'une différence significative entre la liaison hydrogène et la liaison ionique. En outre, une autre différence entre la liaison hydrogène et la liaison ionique est que les liaisons hydrogène sont faciles à briser car elles sont des forces d'attraction intermoléculaires ou intramoléculaires, mais les liaisons ioniques sont de fortes liaisons chimiques qui sont difficiles à briser.
Résumé - Bond hydrogène et liaison ionique
Les liaisons ioniques se produisent dans les composés ioniques. Les liaisons hydrogène sont des liaisons inter-moléculaires. La principale différence entre la liaison hydrogène et la liaison ionique est que la liaison ionique existe entre les anions permanents et les cations, tandis que les liaisons hydrogène existent entre les charges positives partielles et négatives partielles.
Référence:
1. Helmenstine, Anne Marie. «Définition et exemples de liaison hydrogène."Thoughtco, mai. 6, 2019, disponible ici.
2. Helmenstine, Anne Marie. «Définition des obligations ioniques."Thoughtco, Jan. 26, 2019, disponible ici.
Image gracieuseté:
1. «Hydrogène-liaison dans l'eau-2D» (domaine public) via Commons Wikimedia
2. «NaCl ionic Bond» par Mhowison - propre travail (domaine public) via Commons Wikimedia


