Différence entre l'éthane Ethène et Ethyne
La principale différence entre l'éthane Ethène et Ethyne est que L'éthane a des atomes de carbone hybridés SP3 et l'éthène a des atomes de carbone hybridés SP2 tandis que Ethyne a des atomes de carbone hybridés SP.
L'éthane, l'éthène et l'éthyne sont des hydrocarbures importants qui peuvent être trouvés dans le pétrole brut et les gaz naturels. Tous ce sont des composés gazeux car ce sont de très petites molécules.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthane
3. Qu'est-ce que l'éthène
4. Qu'est-ce que Ethyne
5. Similitudes entre l'éthane Ethène et Ethyne
6. Comparaison côte à côte - Ethane Ethène vs Ethyne sous forme tabulaire
7. Résumé
Qu'est-ce que l'éthane?
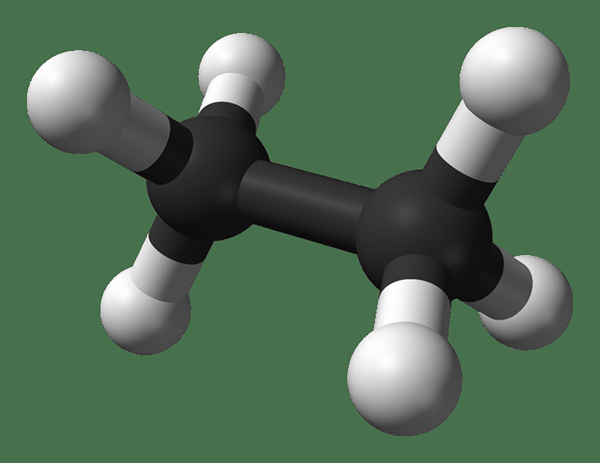
L'éthane est un composé organique ayant la formule chimique C2H6. C'est le deuxième alcane le plus simple. Un alcane est un composé organique n'ayant que des liaisons sigma entre les atomes. Par conséquent, l'éthane n'a que des liaisons uniques dans sa structure chimique; Ainsi, c'est un composé saturé.

Figure 1: Structure chimique de l'éthane
Les atomes de carbone de la molécule d'éthane sont des atomes de carbone hybridés SP3. Cela signifie que chaque atome de carbone de la molécule a quatre liaisons sigma autour d'eux. La géométrie autour d'un atome de carbone est donc tétraédrique. Chaque atome de carbone a trois atomes d'hydrogène liés à eux via des liaisons uniques.
Quelques faits chimiques sur l'éthane
- Formule chimique = C2H6
- Masse molaire = 30.07 g / mol
- État physique à température ambiante = gaz incolore
- Odeur = inodore
- Point de fusion = -182.8 ° C
- Point d'ébullition = −88.5 ° C
L'utilisation la plus courante de l'éthane est de produire de l'éthène via le processus de fissuration à vapeur. De plus, l'éthane est un réfrigérant utilisé dans les systèmes de réfrigération cryogénique.
Qu'est-ce que l'éthène?
L'éthène est un composé organique ayant la formule chimique C2H4. Le nom commun de ce composé est l'éthylène. Il y a une double liaison entre les deux atomes de carbone: une liaison Sigma et une liaison PI. Par conséquent, l'hybridation des atomes de carbone dans cette molécule est une hybridation SP2. Ainsi, la géométrie autour d'un atome de carbone est plane, et il y a des orbitales p non hybrides dans les atomes de carbone. Cela fait de la molécule entière une molécule plane. Puisqu'il y a une double liaison, l'éthène est une molécule insaturée.
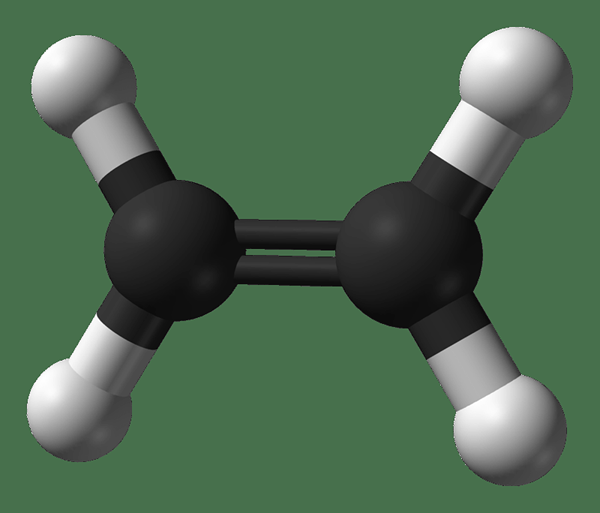
Figure 2: Structure chimique de l'éthène
Quelques faits chimiques sur l'éthène
- Formule chimique = C2H4.
- Masse molaire = 28.05 g / mol
- État physique à température ambiante = gaz inflammable incolore
- Odeur = une odeur douce caractéristique
- Point de fusion = -169.2 ° C
- Point d'ébullition = −103.7 ° C
La double liaison présente dans cette molécule provoque la réactivité de ce composé. De plus, l'éthène est utilisée comme monomère pour la production de polymères tels que le polyéthylène via une polymérisation d'addition. En dehors de cela, l'éthène est une hormone végétale qui peut réguler la maturation des fruits.
Qu'est-ce que Ethyne?
Ethyne est un composé organique ayant la formule chimique C2H2. Le nom commun de ce composé est l'acétylène. Il a une triple liaison entre les deux atomes de carbone: une liaison Sigma et deux liaisons PI. Par conséquent, il n'y a pas d'orbitales P non hybridés dans ces atomes de carbone. Chaque atome de carbone a un atome d'hydrogène lié via une seule liaison. La géométrie de la molécule est linéaire et la structure est planaire.
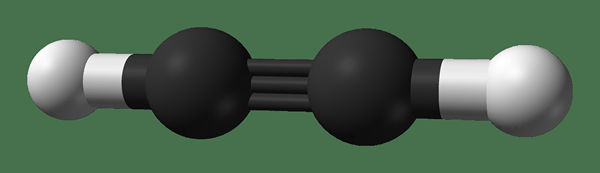
Figure 3: Structure chimique de l'éthyne
Quelques faits chimiques sur l'éthylène
- Formule chimique = C2H2.
- Masse molaire = 26.04 g / mol
- État physique à température ambiante = gaz inflammable incolore
- Odeur = inodore
- Point de fusion = −80.8 ° C (triple point de l'acétylène)
- Point d'ébullition = −84 ° C (point de sublimation)
Plus tôt, Ethyne a été principalement produit par combustion partielle de méthane. Le processus le plus simple de production d'éthyne passe par la réaction entre le carbure de calcium et l'eau. Les produits de cette réaction sont des gaz d'éthyne et du carbonate de calcium. Mais cela est difficile dans les applications industrielles car cela nécessite des températures élevées. Par conséquent, nous utilisons les techniques suivantes dans la production d'éthyne à l'échelle industrielle:
- Production d'éthyne à l'aide de carbure de calcium dans des conditions contrôlées
- Craquage thermique des hydrocarbures
Quelles sont les similitudes entre l'éthane Ethène et Ethyne?
- L'éthane et l'éthyne sont des composés d'hydrocarbures
- Ethane Ethène et Ethyne sont des gaz à température ambiante.
- Les trois composent deux atomes de carbone.
Quelle est la différence entre l'éthane Ethène et Ethyne?
Ethane vs Ethène vs Ethyne | ||
| L'éthane est un composé organique ayant la formule chimique C2H6. | L'éthène est un composé organique ayant la formule chimique C2H4. | Ethyne est un composé organique ayant la formule chimique C2H2. |
| Masse molaire | ||
| La masse molaire d'éthane est de 30.07 g / mol. | La masse molaire d'ethène est de 28.05 g / mol. | La masse molaire d'éthyne est de 26.04 g / mol. |
| Point de fusion | ||
| Le point de fusion de l'éthane est de -182.8 ° C | Ethène a un point de fusion de -169.2 ° C. | Le point de fusion de l'éthyne est de -80.8 ° C. |
| Géométrie | ||
| La géométrie de l'éthane est tétraédrique. | Ethène a une géométrie plane. | La géométrie de l'éthyne est linéaire. |
| Hybridation des atomes de carbone | ||
| Les atomes de carbone de l'éthane sont hybrides SP3. | L'éthène a des atomes de carbone qui sont hybrides SP2. | Les atomes de carbone d'éthyne sont hybrides SP. |
| Odeur | ||
| L'éthane est inodore. | L'ethène a une odeur douce caractéristique. | Ethyne est inodore. |
Résumé - Ethane vs Ethène vs Ethyne
L'éthane, l'éthène et l'éthyne sont de petits composés d'hydrocarbures. Par conséquent, ces composés sont faits uniquement d'atomes d'hydrogène et de carbone. Ils sont différents les uns des autres en fonction de la disposition des atomes et des liaisons chimiques présentes dans les molécules. La principale différence entre l'éthane Ethène et l'éthyne est que l'éthane a des atomes de carbone hybridés SP3 et l'éthène a des atomes de carbone hybridés SP2 tandis qu'Ethyne a des atomes de carbone hybridés SP.
Référence:
1. "Éthane.»Wikipedia, Wikimedia Foundation, 14 avril. 2018, disponible ici.
2. Lazonby, John. «Ethène (éthylène).«L'industrie chimique essentielle en ligne, disponible ici.
3. "Éthylène.»Wikipedia, Wikimedia Foundation, 18 avril. 2018, disponible ici.
4. "Acétylène.»Wikipedia, Wikimedia Foundation, 18 avril. 2018, disponible ici.
Image gracieuseté:
1. «Ethane-A-3D-Balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
2. «Ethylène-CRC-MW-3D-Balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia
3. «Acétylène-CRC-IR-3D-balls» par Ben Mills - Propre travaux (domaine public) via Commons Wikimedia


