Différence entre l'estérification et la saponification
La principale différence entre l'estérification et la saponification est que L'estérification forme un ester tandis que la saponification décompose les esters dans ses matériaux de départ.
Un ester est formé à partir d'un acide carboxylique et d'un alcool. Par conséquent, l'estérification est la formation d'un ester à partir d'un acide carboxylique et d'un alcool. Tandis que la saponification forme l'acide carboxylique et l'alcool qui sont utilisés pour produire l'ester.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'estérification
3. Qu'est-ce que la saponification
4. Comparaison côte à côte - estérification vs saponification sous forme tabulaire
5. Résumé
Qu'est-ce que l'estérification?
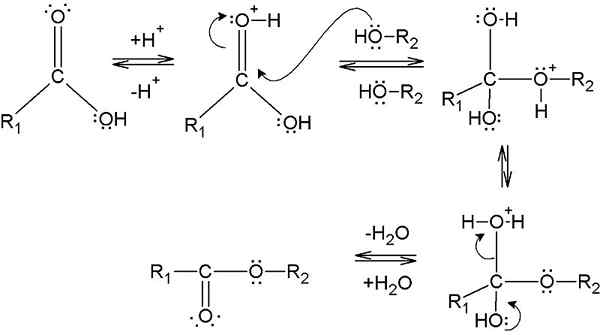
L'estérification est la formation d'un ester de la réaction entre un acide carboxylique et un alcool. Ce processus nécessite un catalyseur afin de réduire la barrière d'énergie d'activation de la réaction. Ce catalyseur est généralement un catalyseur acide. De plus, le mélange réactionnel doit être chauffé car le processus d'estérification nécessite de l'énergie (pour cliver la liaison C-OH de l'acide carboxylique pour éliminer le groupe -OH).

Figure 1: Formation d'un ester par estérification
Le processus d'estérification implique l'élimination du groupe hydroxyle (-OH) de l'acide carboxylique et l'atome d'hydrogène du groupe hydroxyle de l'alcool. Au cours de ce processus, lorsque le groupe -OH est retiré de l'acide carboxylique, il agit comme un électrophile. Et lorsque le proton de l'alcool est retiré, il agit comme un nucléophile. Par conséquent, ce nucléophile attaque l'électrophile formé à partir de l'acide carboxylique et forme un ester. Cela donne une molécule d'eau comme sous-produit. Ainsi, la molécule d'eau se forme à partir de la combinaison du groupe -OH de l'acide carboxylique et du proton de l'alcool. Par conséquent, on peut obtenir un ester pur en utilisant un agent déshydratant (afin d'éliminer l'eau du mélange réactionnel).
Qu'est-ce que la saponification?
La saponification est la dégradation d'un ester en acide carboxylique et un alcool. C'est l'opposé de l'estérification. La saponification se produit dans un milieu aqueux en présence d'une base. Les conditions de base du milieu rendent l'anion carboxylate plus stable que la forme acide carboxylique. Par conséquent, l'ion carboxylate se sépare de l'ester. La saponification peut se produire en l'absence d'énergie thermique car elle n'a pas de barrière d'énergie. Ici, les molécules d'eau dans le milieu aqueux fournissent H+ ions, et la base fournit oh- ions requis pour la formation d'alcool et d'acide carboxylique respectivement.
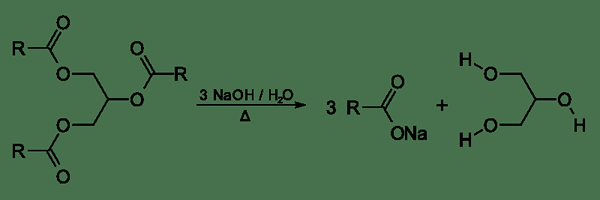
Figure 2: Processus général de saponification
Mécanisme de réaction de saponification:
- Attaque nucléophile
- Réarrangement
- Suppression du groupe de départ
- Déprotonation
Les ions hydroxyles (oh-) agir comme des nucléophiles car ils sont riches d'électrons. Ces ions peuvent attaquer la liaison ester (-c-oo) de l'ester. Ils attaquent l'atome de carbone de cette liaison car l'atome de carbone a une charge positive partielle en raison de la présence d'atomes d'oxygène attachés à l'atome de carbone. Ensuite, l'ion oh forme une liaison covalente avec l'atome de carbone. Mais l'atome de carbone ne peut pas avoir cinq liaisons covalentes car elle est un état de carbone instable. Par conséquent, une étape de réarrangement a lieu après cette formation de liaison. Dans l'étape de réarrangement, les molécules deviennent stables par l'élimination du groupe ou provenant de l'alcool qui a été utilisé pour faire l'ester). C'est le groupe de départ de la réaction de saponification. Une déprotonation de l'acide carboxylique a lieu car l'ion carboxylate est la forme stable dans un milieu de base.
Quelle est la différence entre l'estérification et la saponification?
Estérification vs saponification | |
| L'estérification est la formation d'un ester de la réaction entre un acide carboxylique et un alcool. | La saponification est la dégradation d'un ester en acide carboxylique et un alcool. |
| Exigence d'énergie | |
| L'estérification nécessite de l'énergie sous forme de chaleur. | La saponification ne nécessite pas d'énergie externe. |
| Réactifs | |
| Les réactifs de l'estérification sont l'alcool et l'acide carboxylique. | Les réactifs de la saponification sont ester et base avec l'eau. |
| Catalyseur | |
| L'estérification nécessite un catalyseur acide. | La saponification nécessite un catalyseur de base. |
Résumé - Estérification vs Saponification
L'estérification et la saponification sont des réactions chimiques importantes en chimie. L'estérification est la synthèse d'ester, et la saponification est une rupture de la liaison ester. La principale différence entre l'estérification et la saponification est que le processus d'estérification implique la formation d'un ester tandis que le processus de saponification implique de décomposer un ester en ses matériaux de départ.
Référence:
1. Helmenstine, Anne Marie, Ph.D. «Définition et réaction de la saponification.”Thoughtco, oct. 3, 2017, disponible ici.
2. «Saponification.»Wikipedia, Wikimedia Foundation, 3 avril. 2018, disponible ici.
3. Estérification - Alcools et acides carboxyliques. Disponible ici.
Image gracieuseté:
1. «Formation des esters» par Laghi.L - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «SaponificationGenera» par V8rik à English Wikipedia (CC BY-SA 3.0) via Commons Wikimedia


