Différence entre l'éthane et l'éthanol
Le différence clé entre l'éthane et l'éthanol est que L'éthane est un alcane alors que l'éthanol est un alcool.
L'éthane et l'éthanol sont des composés organiques. Cependant, ceux-ci diffèrent les uns des autres de plusieurs manières. En conséquence, l'éthane est un alcane, ce qui signifie qu'il n'a pas de liaisons doubles ou triples entre les atomes de carbone; Seules obligations uniques. L'éthanol est un alcool, ce qui signifie qu'il a un groupe hydroxyle (-OH) comme groupe fonctionnel.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'éthane
3. Qu'est-ce que l'éthanol
4. Comparaison côte à côte - éthane vs éthanol sous forme tabulaire
5. Résumé
Qu'est-ce que l'éthane?
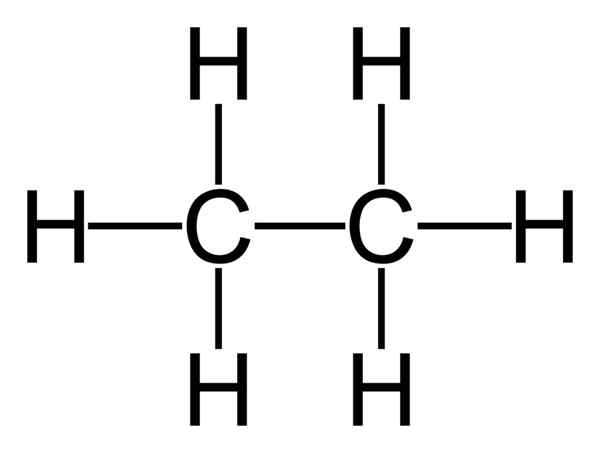
L'éthane est un composé organique ayant la formule chimique C2H6. C'est un alcane et une molécule d'hydrocarbures aliphatiques simple. L'éthane est un hydrocarbure car il se compose uniquement d'atomes de carbone et d'hydrogène. L'éthane est un alcane car il n'a pas plusieurs liaisons entre les atomes de carbone. De plus, les atomes de carbone de l'éthane contiennent le nombre maximal d'atomes d'hydrogène que ces atomes de carbone peuvent posséder, ce qui en fait un alcane saturé.

Figure 01: Structure chimique de l'éthane
L'éthane existe en tant que gaz incolore et inodore à la température et à la pression standard. Le poids moléculaire de ce composé est de 30 g mol-1. De plus, chaque atome de carbone dans cette molécule a une géométrie tétraédrique. Par conséquent, l'angle de liaison H-C-H est 109o. Les atomes de carbone en éthane sont SP3 atomes hybridés. Là, un sp3 L'orbitale hybridé de chaque atome de carbone se chevauche pour faire la liaison carbone-carbone Sigma. La liaison entre le carbone et l'hydrogène est également une liaison sigma, mais elle est constituée en chevauchant un SP3 orbitale hybride du carbone avec la seule orbitale s de l'atome d'hydrogène.
En raison de la liaison sigma unique entre les atomes de carbone, la rotation des liaisons dans l'éthane est possible et il ne nécessite pas une grande quantité d'énergie. L'éthane est une composante du gaz naturel, nous pouvons donc l'isoler à partir du gaz naturel à grande échelle. De plus, nous pouvons obtenir ce composé gazeux comme sous-produit du raffinage du pétrole.
Qu'est-ce que l'éthanol?
L'éthanol est un simple alcool avec la formule moléculaire de C2H5OH. C'est un liquide clair et incolore avec une odeur caractéristique. De plus, il existe un liquide inflammable à la température et à la pression standard. Le point de fusion de cet alcool est de -114.1 oC, et le point d'ébullition est 78.5 oC. En dehors de cela, l'éthanol est polaire en raison de la différence d'électronégativité entre l'oxygène et l'hydrogène dans le groupe -OH. Également en raison du groupe -OH, il a la capacité de former des liaisons hydrogène.
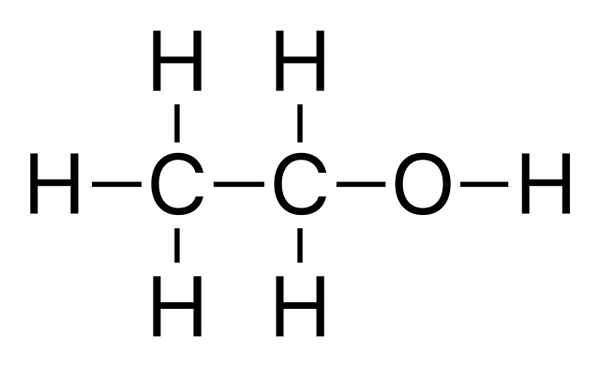
Figure 02: Structure chimique de l'éthanol
L'éthanol est utile comme boisson. Selon le pourcentage d'éthanol, il existe différents types de boissons telles que le vin, la bière, le whisky, le brandy, l'arrack, etc. De plus, nous pouvons facilement obtenir cet alcool via le processus de fermentation du sucre à l'aide d'une enzyme zymase. Cette enzyme se présente naturellement dans la levure, donc dans la respiration anaérobie, la levure peut produire de l'éthanol. L'éthanol est toxique pour le corps, et il se transforme en acétaldéhyde dans le foie, qui est également toxique. À part une boisson, il est utile comme antiseptique pour nettoyer les surfaces des micro-organismes. Principalement, nous pouvons l'utiliser comme carburant et additif de carburant dans les véhicules. L'éthanol est miscible avec de l'eau, et il sert également de bon solvant.
Quelle est la différence entre l'éthane et l'éthanol?
L'éthane est un composé organique ayant la formule chimique C2H6 tandis que l'éthanol est un simple alcool avec la formule moléculaire de C2H5OH. La principale différence entre l'éthane et l'éthanol est que l'éthane est un alcane alors que l'éthanol est l'alcool. Cependant, les deux sont des composés organiques. Lorsque vous envisagez la composition chimique de deux composés, l'éthane contient des atomes de carbone et d'hydrogène tandis que l'éthanol a des atomes de carbone, d'hydrogène et d'oxygène. De plus, les températures de fusion et d'ébullition de l'éthanol sont relativement plus élevées que celles de l'éthane car l'éthanol peut former des liaisons fortes telles que les liaisons hydrogène entre les molécules que l'éthane ne peut pas.
Comme autre différence importante entre l'éthane et l'éthanol, l'éthane existe en tant que composé gazeux alors que l'éthanol existe en tant que composé liquide à une température standard et à des conditions de pression. L'infographie ci-dessous sur la différence entre l'éthane et l'éthanol montre plus de différences entre les deux.
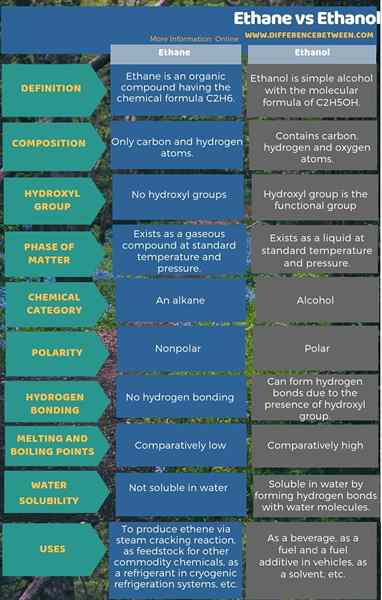
Résumé - éthane vs éthanol
L'éthane et l'alcool sont des composés organiques importants qui ont des utilisations dans les industries ainsi que dans de nombreux autres domaines tels que la médecine, la synthèse chimique, etc. La principale différence entre l'éthane et l'éthanol est que l'éthane est un alcane alors que l'éthanol est l'alcool.
Référence:
1. "Éthane.”Ohio River - Encyclopédie du Nouveau Monde, Encyclopédie du Nouveau Monde. Disponible ici
2. Jill A. Richardson DVM, dans Small Animal Toxicology (troisième édition), 2013
Image gracieuseté:
1.«Éthane-flat» (domaine public) via les communes Wikimedia
2.«Éthanol-structure» par Lukáš Mižoch - Propre travaux, (domaine public) via Commons Wikimedia


