Différence entre le poids atomique et la masse atomique
Le différence clé entre le poids atomique et la masse atomique est que Le poids atomique est le poids moyen d'un élément, en ce qui concerne tous ses isotopes et leurs abondances relatives, mais la masse atomique est la masse d'un seul atome.
La plupart des gens utilisent les termes de la masse atomique et du poids atomique de manière interchangeable. Cependant, ils ont des significations différentes, et cela provoque une erreur significative dans les calculs des matériaux en vrac si nous prenons ces deux termes comme un.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le poids atomique
3. Qu'est-ce que la masse atomique
4. Comparaison côte à côte - poids atomique vs masse atomique sous forme tabulaire
5. Résumé
Qu'est-ce que le poids atomique?
Le poids atomique est le poids moyen d'un élément, en ce qui concerne tous ses isotopes et leurs abondances relatives. La plupart du temps, les éléments chimiques ont des isotopes; Les isotopes sont les différentes formes du même élément chimique. Les isotopes ont le même nombre de protons (ce qui les fait appartenir au même élément chimique) et un nombre différent de neutrons dans le noyau atomique. Il existe différents pourcentages de différents isotopes qui se produisent dans la nature. Nous devons considérer les masses atomiques de tous les isotopes et leurs pourcentages lors de l'obtention du poids atomique d'un élément chimique. Là, nous pouvons calculer la masse moyenne en utilisant les masses atomiques de chaque isotope pour obtenir le poids atomique. Le poids atomique que nous voyons dans le tableau périodique est calculé selon ce phénomène.
Nous pouvons utiliser les deux étapes suivantes pour ce calcul;
- Tout d'abord, convertissez les pourcentages en valeurs décimales en les divisant avec 100.
- Ensuite, multipliez les masses atomiques de chaque isotope de ces valeurs décimales en conséquence.
- Enfin, ajoutez les réponses ensemble pour obtenir la réponse finale.
Vidéo 1: Calcul du poids atomique
Exemple: Supposons que nous ayons 98% de l'isotope C-12 et 2% de l'isotope C-13 dans la nature. Calculons le poids atomique du carbone en utilisant les masses atomiques de ces isotopes.
- Conversion en valeurs décimales:
- La valeur décimale du pourcentage de C-12 est 0.98 (obtenu en divisant 98 à partir de 100).
- La valeur décimale du pourcentage de C-13 est 0.02 (obtenu en divisant 2 à partir de 100).
- Multiplication des masses atomiques de chaque isotope à partir des valeurs décimales:
- 12 x 0.98 = 11.76
- 13 x 0.02 = 0.26
- Ajout de réponses ensemble pour obtenir la réponse finale:
- 76 + 0.26 = 12.02
Finalement, nous pouvons obtenir le poids atomique du carbone de l'élément chimique comme 12.02 AMU (unités de masse atomique). De plus, nous pouvons nommer ce terme comme une «masse atomique relative» car il s'agit d'une moyenne de masses atomiques réelles d'isotopes.
Qu'est-ce que la masse atomique?
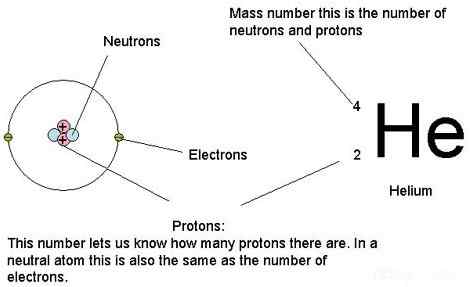
Les atomes contiennent principalement des protons, des neutrons et des électrons. La masse atomique est simplement la masse d'un atome. En d'autres termes, c'est la collection de masses de tous les neutrons, protons et électrons dans un seul atome, en particulier, lorsque l'atome ne se déplace pas (masse de repos). Nous ne prenons que la masse de repos parce que selon les principes fondamentaux de la physique lorsque les atomes se déplacent à une vitesse très élevée, les masses augmentent. Cependant, la masse d'électrons est considérablement très petite par rapport aux masses de protons et de neutrons. Par conséquent, nous pouvons dire que la contribution des électrons à une masse atomique est moindre. Nous pouvons donc négliger la masse d'un électron lors du calcul de la masse atomique. Surtout, différents isotopes ont des masses atomiques différentes bien qu'elles appartiennent au même élément chimique car ils ont un nombre différent de neutrons.

Figure 01: Nous pouvons utiliser les masses de protons, neutrons et électrons d'un atome pour calculer la masse atomique
De plus, les masses d'atomes sont extrêmement petites, nous ne pouvons donc pas les exprimer dans des unités de masse normales comme les grammes ou les kilogrammes. Pour nos besoins, nous utilisons une autre unité d'unité de masse atomique (AMU) pour mesurer la masse atomique. De même, 1 unité de masse atomique est la douzième de la masse d'un isotope C-12. Lorsque nous divisons une masse d'un atome de la masse d'un douzième de la masse d'un isotope C-12, nous pouvons obtenir sa masse relative. Cependant, dans l'usage général lorsque nous disons la masse atomique relative d'un élément, nous entendons leur poids atomique (parce que nous le calculons compte tenu de toutes les isotopes).
Quelle est la différence entre le poids atomique et la masse atomique?
La plupart du temps, nous utilisons les termes le poids atomique et la masse atomique. Cependant, ces deux termes diffèrent les uns des autres, principalement selon la définition. Par conséquent, selon la définition, la principale différence entre le poids atomique et la masse atomique est que le poids atomique est le poids moyen d'un élément, en ce qui concerne tous ses isotopes et leurs abondances relatives alors que la masse atomique est la masse d'un seul atome.
De plus, nous pouvons identifier une autre différence importante entre le poids atomique et la masse atomique en considérant la façon de calculer chaque valeur; Nous devons calculer le poids atomique en utilisant le pourcentage d'abondance de tous les isotopes d'un élément chimique dans la nature tandis que nous pouvons calculer la masse atomique simplement en ajoutant les masses de protons, de neutrons et d'électrons d'un atome.
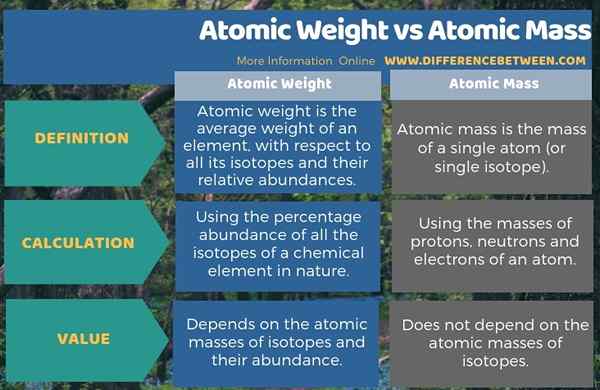
Résumé - Poids atomique vs masse atomique
Le poids atomique et la masse atomique sont deux termes importants que nous utilisons souvent dans les calculs chimiques. La principale différence entre le poids atomique et la masse atomique est que le poids atomique est le poids moyen d'un élément, en ce qui concerne tous ses isotopes et leurs abondances relatives tandis que la masse atomique est la masse d'un seul atome.
Référence:
1. Wichers, Edward et H. Steffen Peiser. "Poids atomique.»Encyclopædia Britannica, Encyclopædia Britannica, Inc., 15 décembre. 2017. Disponible ici
2. Helmenstine, Anne Marie, Ph.D. «Comment calculer la masse atomique.”Thoughtco, avril. 1, 2018. Disponible ici
Image gracieuseté:
1.»133317385" par elearn.Punjab (CC0) via Vimeo
2.«Numéro atomique Représentation» par MaterialScientist (CC0) via Commons Wikimedia


