Différence entre le point d'équivalence et le point final
Le différence clé entre le point d'équivalence et le point final est que le Le point d'équivalence dans un titrage est le point auquel le titrant ajouté est chimiquement équivalent complètement à l'analyte dans l'échantillon tandis que le point final est le point où l'indicateur change sa couleur.
Le titrage est une technique que nous utilisons largement en chimie analytique pour déterminer les acides, les bases, les oxydants, les réductants, les ions métalliques et de nombreuses autres espèces. Dans un titrage, une réaction chimique a lieu. Ici, un analyte réagit avec un réactif standard, que nous appelons un titrant. Parfois, nous utilisons une norme primaire, qui est une solution hautement purifiée et stable, comme matériel de référence dans les méthodes titrimétriques. Nous utilisons un indicateur afin de détecter le point final de la réaction. Mais ce n'est pas le point réel où la réaction chimique se termine. Le point réel est le point d'équivalence.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le point de terminaison
3. Qu'est-ce que le point d'équivalence
4. Comparaison côte à côte - point d'équivalence vs point de terminaison sous forme tabulaire
5. Résumé
Qu'est-ce que le point de terminaison?
Dans n'importe quel titrage, le point final est le point où l'indicateur change sa couleur. Ou bien nous pouvons utiliser un changement dans une réponse instrumentale pour identifier le point final. Par exemple, HCl et Naoh réagissent 1: 1 et produisent du NaCl et de l'eau. Pour ce titration, nous pouvons utiliser l'indicateur de phénolphtalale, qui a une couleur rose dans le milieu de base et se transforme en incolore dans le milieu acide. Si nous mettons HCL dans le ballon de titration et à cela, si nous ajoutons une goutte de phénolphtaleine, elle devient incolore.

Figure 02: Le point de terminaison est le point de changement de couleur
Pendant le titrage, nous pouvons ajouter Naoh de la bureautte et progressivement, HCl et Naoh réagiront dans le ballon. Si nous prenons la même concentration des deux solutions, lorsque nous ajoutons une quantité égale de NaOH au ballon, la solution dans le ballon se tourne vers une couleur rose clair. C'est le point où nous arrêtons le titrage (point de terminaison). Nous considérons, à ce stade, la réaction est terminée.
Qu'est-ce que le point d'équivalence?
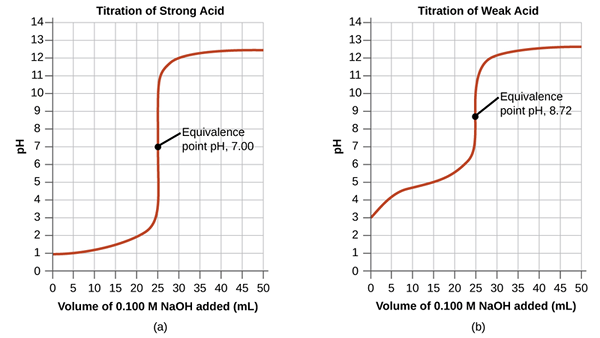
Le point d'équivalence dans un titrage est le point auquel le titrant ajouté est chimiquement équivalent complètement à l'analyte de l'échantillon. C'est le point où la réaction chimique termine.

Figure 01: Points d'équivalence pour un titrage acide et acide faible et faible
Bien que nous déterminions le point final du changement de couleur de l'indicateur, il est, la plupart du temps, pas le point final réel de la réaction. La réaction se termine légèrement avant ce point. À ce point d'équivalence, le milieu est neutre. Dans l'exemple discuté dans la section précédente, après avoir ajouté une goutte de NaOH supplémentaire, le médium montrera la couleur de base de la phénolphtaleine, que nous prenons comme point final.
Quelle est la différence entre le point d'équivalence et le point final?
Le point d'équivalence dans un titrage est le point auquel le titrant ajouté est chimiquement équivalent complètement à l'analyte dans l'échantillon tandis que le point final est le point où l'indicateur change sa couleur. C'est la principale différence entre le point d'équivalence et le point final. De plus, le point d'équivalence vient toujours avant le point final du titrage.

Résumé - point d'équivalence vs point de terminaison
Dans tout titrage, nous avons deux points importants; à savoir, point et point final équivalent du titrage. La principale différence entre le point d'équivalence et le point final est que le point d'équivalence dans un titrage est le point auquel le titrant ajouté est chimiquement équivalent complètement à l'analyte dans l'échantillon tandis que le point final est le point où l'indicateur change sa couleur.
Référence:
1. "Point d'équivalence.»Wikipedia, Wikimedia Foundation, 15 avril. 2018. Disponible ici
2. LibreTexts. «Fondamentaux de titrage.”Chemistry LibreTexts, LibreTexts, 21 juillet 2016. Disponible ici
Image gracieuseté:
1.«CNX Chem 14 07 titration» par OpenStax (CC par 4.0) via Commons Wikimedia
2.”PHENOLPHTHALEIN EN FLASK” par 384 - Propre travaux, (CC BY-SA 4.0) via Commons Wikimedia


