Différence entre le spectre continu et le spectre de ligne
Le différence clé entre le spectre continu et le spectre de ligne est que le Le spectre continu contient toutes les longueurs d'onde dans une plage donnée alors que le spectre de ligne ne contient que quelques longueurs d'onde.
Il existe principalement deux types de spectres comme spectre continu et spectre de ligne. Le spectre de ligne peut créer un spectre d'absorption ou un spectre d'émission. Les spectres d'absorption et d'émission d'une espèce aident à identifier ces espèces et à fournir beaucoup d'informations à leur sujet.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le spectre continu
3. Qu'est-ce que le spectre de ligne
4. Comparaison côte à côte - spectre continu vs spectre de ligne dans la forme tabulaire
5. Résumé
Qu'est-ce que le spectre continu?
Lorsque les spectres d'absorption et d'émission d'une espèce sont assemblés, ils forment un spectre continu. Un spectre d'absorption est un tracé dessiné entre l'absorbance et la longueur d'onde. Parfois, au lieu de la longueur d'onde, nous pouvons également utiliser la fréquence ou le nombre d'ondes dans l'axe X. La valeur d'absorption du journal ou la valeur de transmission est également utile pour l'axe y à certaines occasions. Le spectre d'absorption est caractéristique pour une molécule donnée ou un atome. Par conséquent, nous pouvons l'utiliser pour identifier ou confirmer l'identité d'une espèce particulière.

Figure 01: Spectres continus
Ainsi, si toutes les longueurs d'onde sont présentes dans une limite donnée, c'est un spectre continu. Par exemple, l'arc-en-ciel a les sept couleurs, et c'est un spectre continu. Formes de spectre continu Lorsque des objets chauds comme les étoiles, les lunes émettent des rayonnements électromagnétiques à toutes les longueurs d'onde.
Qu'est-ce que le spectre de ligne?
Comme son nom le dit, le spectre de ligne n'a que quelques lignes. En d'autres termes, ils ont peu de longueurs d'onde. Par exemple, un composé coloré est visible à nos yeux dans cette couleur particulière car il absorbe la lumière de la gamme visible. En fait, il absorbe la couleur complémentaire de la couleur que nous voyons. Par exemple, nous voyons un objet comme vert car il absorbe la lumière violette de la plage visible. Ainsi, le violet est la couleur complémentaire du vert.

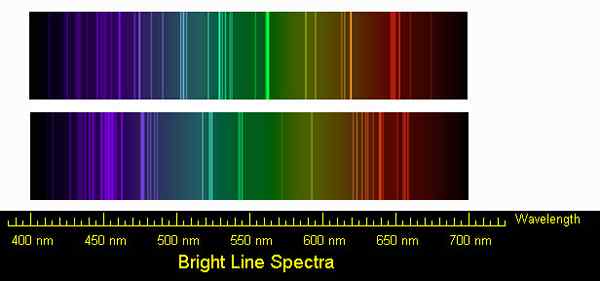
Figure 02: Spectres de ligne pour les émissions de sodium et de calcium
De même, les atomes ou les molécules absorbent également certaines longueurs d'onde du rayonnement électromagnétique (ces longueurs d'onde ne doivent pas nécessairement être dans la plage visible). Lorsqu'un faisceau de rayonnement électromagnétique passe à travers un échantillon contenant des atomes gazeux, seules certaines longueurs d'onde sont absorbées par les atomes. Par conséquent, lorsque nous enregistrons le spectre, il se compose d'un certain nombre de lignes d'absorption très étroites. Et c'est un spectre de ligne d'absorption. Il est caractéristique d'un type d'atome. Les atomes utilisent l'énergie absorbée pour exciter les électrons de terre aux niveaux supérieurs dans l'atome. Étant donné que la différence d'énergie est discrète et constante, le même type d'atomes absorbera toujours les mêmes longueurs d'onde du rayonnement donné. Lorsque cet électron excité revient au niveau du sol, il émet le rayonnement absorbé et il formera un spectre de ligne d'émission.
Quelle est la différence entre le spectre continu et le spectre de ligne?
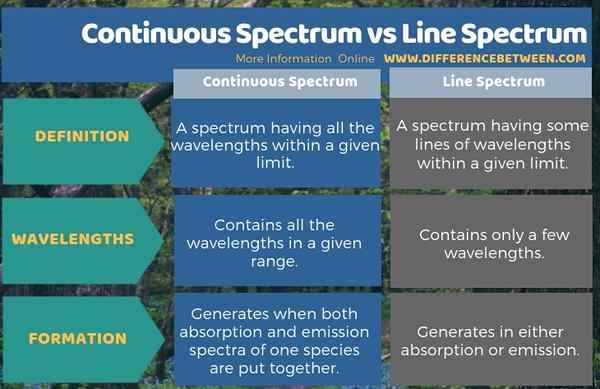
Le spectre continu est un spectre ayant toutes les longueurs d'onde dans une limite donnée tandis que le spectre de ligne est un spectre ayant certaines lignes de longueurs d'onde dans une limite donnée. Ainsi, le spectre continu et le spectre de ligne diffèrent les uns des autres en fonction de la présence ou de l'absence de lignes dans le spectre. Par conséquent, nous pouvons considérer cela comme la différence clé entre le spectre continu et le spectre de ligne. Ces lignes se produisent en spectre de ligne car elle ne contient que quelques longueurs d'onde tandis que le spectre continu contient toutes les longueurs d'onde dans une plage donnée.
Lorsque vous envisagez la formation de chaque spectre, nous pouvons trouver une autre différence significative entre le spectre continu et le spectre de ligne. C'est-à-dire que dans la formation d'un spectre continu, les spectres d'absorption et d'émission d'une espèce sont assemblés tandis que le spectre d'absorption ou d'émission génère le spectre de ligne.
Résumé - Spectre continu vs spectre de ligne
Le spectre continu et le spectre de ligne sont deux types de spectres d'absorption et d'émission. La principale différence entre le spectre continu et le spectre de ligne est que le spectre continu contient toutes les longueurs d'onde dans une plage donnée alors que le spectre de ligne ne contient que quelques longueurs d'onde.
Référence:
1. LibreTexts. «6.3: Spectres de ligne et modèle Bohr.”Chemistry LibreTexts, LibreTexts, 25 juillet 2018. Disponible ici
Image gracieuseté:
1.«Spectrum-srgb» par phrood - propre travail, (domaine public) via Commons Wikimedia
2.«Spectres de sodium et de calcium» par la NASA (domaine public) via Commons Wikimedia


