Différence entre l'électrovalité et la covalence
Le différence clé entre électrovalence et covalence est que le L'électrovalité est le nombre d'électrons qu'un atome gagne ou pertes dans la formation d'un ion tandis que la covalence est le nombre d'électrons qu'un atome peut partager avec un autre atome.
Bien que les termes électrovalence et covalence semblent similaires, ils sont différents les uns des autres en fonction de leurs définitions. Principalement, l'électrovalité explique la formation d'un ion tandis que la covalence explique la formation d'une liaison covalente.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'électrovalité
3. Qu'est-ce que la covalence
4. Comparaison côte à côte - Électrovalité vs covalence sous forme tabulaire
5. Résumé
Qu'est-ce que l'électrovalité?
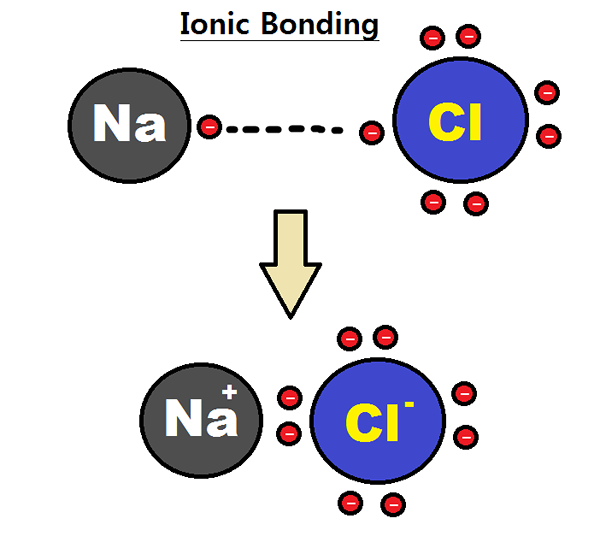
L'électrovalité est le nombre d'électrons gagnés ou perdus pendant la formation d'un ion à partir de cet atome. Par conséquent, il fait référence au nombre d'électrons qu'un atome gagne ou pertes lors de la formation d'une liaison électrovalente, nous l'appelons une liaison ionique. Selon cette explication, il donne la charge électrique nette sur un ion. De plus, si un atome perd des électrons lors de la formation d'une liaison ionique indique une électrovalence positive tandis que si un atome gagne des électrons lors de la formation d'une liaison ionique, cela indique que l'atome a une électrovalence négative. Les composés avec des atomes ayant une électrovalence sont des composés ioniques.

Figure 01: Formation d'une liaison ionique
Par exemple, considérons la formation de chlorure de sodium (NaCl). Là, l'atome de sodium perd un électron; Ainsi, il a une électrovalence positive. L'atome de chlore gagne cet électron. Ainsi, il a une électrovalité négative. Cependant, comme le nombre d'électrons qui sont perdus ou gagnés en est un, l'électrovalité du sodium (ou du chlore) est une,. Nous devons donner l'électrovalité avec le soupir approprié afin d'indiquer s'il s'agit d'une électrovalité positive ou négative.
- Sodium = électrovalence positive Le sodium peut être donné comme +1.
- Chlore = électrovalence négative du chlore peut être donné comme -1.
Qu'est-ce que la covalence?
La covalence est le nombre maximum d'électrons qu'il peut partager avec un autre atome. Par conséquent, il indique le nombre maximum d'obligations covalentes qu'un atome peut former en utilisant ses orbitales vides. La valeur de ce paramètre dépend du nombre d'électrons de valence d'un atome et du nombre d'orbitales vides présentes dans un atome.
Par exemple, un atome d'hydrogène n'a qu'un seul électron; Ainsi, il peut partager un électron avec un autre atome. Par conséquent, la covalence de l'hydrogène est 1. Contrairement à l'électrovalité, nous n'avons pas besoin de signes plus ou moins car il n'y a pas de perte ni de gain d'électrons; Seuls les électrons sont partagés les uns avec les autres.
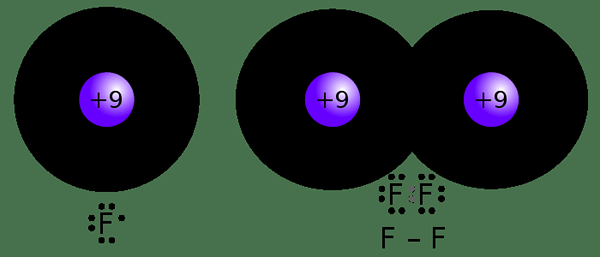
Figure 02: Formation d'une liaison covalente
Comme nous l'avons mentionné ci-dessus, non seulement le nombre d'électrons de valence, mais aussi le nombre d'orbitales vides d'un atome est important pour déterminer la covalence. Par exemple, si nous considérons le carbone comme exemple, il a 4 électrons dans la coque d'électrons la plus externe. Là, il a le 2S22p2 configuration d'électrons. Par conséquent, il y a une orbitale 2p vide. Par conséquent, les deux électrons appariés dans l'orbitale 2S peuvent se séparer, et un électron est inclus dans l'orbital 2p vide. Ensuite, il y a 4 électrons non appariés. Le carbone peut partager les quatre électrons avec un autre atome. Par conséquent, la covalence de devient 4. En effet, lorsque nous écrivons la configuration électronique du carbone, nous voyons qu'il n'y a que 2 électrons non appariés, donc nous pensons que la covalence du carbone est 2 alors qu'elle est en fait 4.
Quelle est la différence entre l'électrovalité et la covalence?
L'électrovalité est le nombre d'électrons gagnés ou perdus pendant la formation d'un ion à partir de cet atome. Il explique la formation d'un lien ionique. De plus, les composés ayant des atomes avec ce paramètre sont des composés ioniques. La covalence, en revanche, est le nombre maximum d'électrons qu'il peut partager avec un autre atome. Il explique la formation d'une liaison covalente. De plus, les composés ayant des atomes avec une covalence sont des composés covalents.
L'infographie ci-dessous présente la différence entre l'électrovalité et la covalence sous forme tabulaire.

Résumé - Électrovalité vs covalence
Bien que les termes électrovalence et de covalence semble similaires, ils ont des définitions et des caractéristiques distinctes. La différence entre l'électrovalité et la covalence est que l'électrovalence est le nombre d'électrons qu'un atome gagne ou pertes dans la formation d'un ion tandis que la covalence est le nombre d'électrons qu'un atome peut partager avec un autre atome.
Référence:
1. «2. Idée élémentaire de liaison.»Rôle du PH dans la chimie de la vie quotidienne. Disponible ici
2. «Chimie-covalence et structures moléculaires.”Recherche de temps de réponse système-réponse biologie nerveuse. Disponible ici
Image gracieuseté:
1."IonicBondingrh11" par Rhannosh - propre travail, (CC By-Sa 3.0) via Commons Wikimedia
2.«Fluorine de liaison covalente» par Jacek FH - Propre travaux, (CC BY-SA 3.0) via Commons Wikimedia


