Différence entre la dissociation et la solvatation
Le différence clé entre la dissociation et la solvatation est que La dissociation est la dégradation d'une substance en atomes ou ions à partir desquels la substance est faite tandis que la solvatation est la dissolution d'une substance dans un solvant en raison des forces d'attraction entre les molécules de solvant et les composants de la substance.
La dissociation et la solvatation se trouvent souvent dans la chimie analytique et dans la chimie inorganique, concernant la dégradation des substances chimiques sur différentes interactions entre les atomes et les ions dans une substance.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la dissociation
3. Qu'est-ce que la solvatation
4. Comparaison côte à côte - dissociation vs solvatation sous forme tabulaire
5. Résumé
Qu'est-ce que la dissociation?
Le terme dissociation fait référence à la dégradation ou à la division d'un composé en particules plus petites. Le processus de dissociation forme des produits qui sont soit chargés électriquement ou neutres. Cela signifie; Les produits de dissociation peuvent être ioniques ou non ioniques. Cependant, cela n'implique pas le gain ou la perte d'électrons par les atomes.
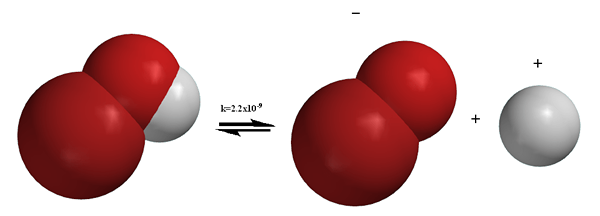
Figure 01: Dissociation de la molécule broh
Contrairement au processus d'ionisation, la dissociation implique la séparation des ions qui existaient déjà dans un composé. Parfois, la dissociation peut également produire des particules neutres pour l'exemple, la panne de n2O4 entraîne la production de deux molécules de non2. Les processus de dissociation sont réversibles la plupart du temps. Cela signifie que les ions séparés peuvent être réorganisés pour produire le composé précédent. Par exemple, comme mentionné ci-dessus, la dissolution du NaCl est un processus de dissociation, et il produit deux particules chargées. Mais, le NaCl solide peut être obtenu à nouveau avec des conditions appropriées données, ce qui prouve que la dissociation est réversible. Contrairement à l'ionisation, la dissociation se déroule dans les composés ioniques.
Qu'est-ce que la solvatation?
La solvatation est la dissolution d'une substance dans un solvant particulier. La solvatation se produit en raison de la force d'attraction entre les molécules du solvant et les molécules de soluté. Habituellement, les forces d'attraction impliquées dans ce processus sont des liaisons ion-dipoles et des attractions de liaison hydrogène. Ces forces d'attraction provoquent la dissolution d'un soluté dans un solvant.

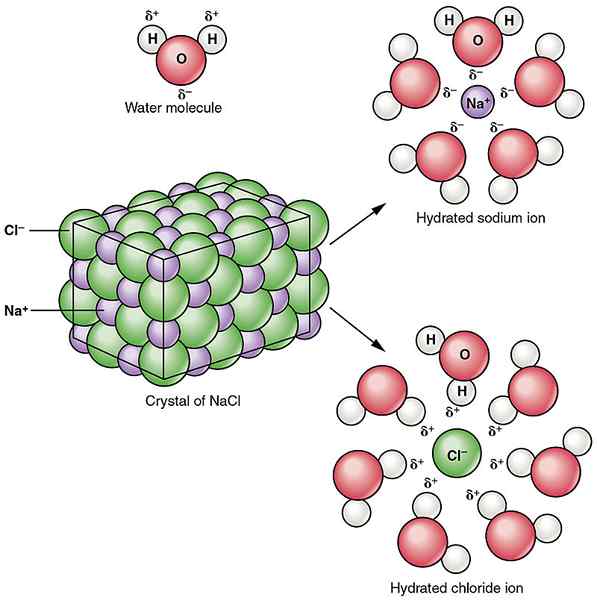
Figure 02: Solvatation du composé ionique de chlorure de sodium dans l'eau
Les interactions ion-dipoles peuvent être trouvées entre les composés ioniques et les solvants polaires. E.g. L'eau est un solvant polaire. Lorsque du chlorure de sodium est ajouté à l'eau, les molécules d'eau polaire attirent séparément les ions sodium et le chlorure, ce qui fait que les ions sodium et chlorure se séparent. Il en résulte la dégradation du composé ionique du chlorure de sodium.
Quelle est la différence entre la dissociation et la solvatation?
La dissociation et la solvatation sont des termes qui décrivent comment différentes substances se divisent en petits morceaux ou atomes / ion en fonction des interactions. La principale différence entre la dissociation et la solvatation est que la dissociation est la dégradation d'une substance en atomes ou ions à partir desquels la substance est faite tandis que la solvatation est la dissolution d'une substance dans un solvant en raison des forces d'attraction entre les molécules de solvant et les composants de la substance.
La tabulation ci-dessous montre plus de différences entre la dissociation et la solvatation.
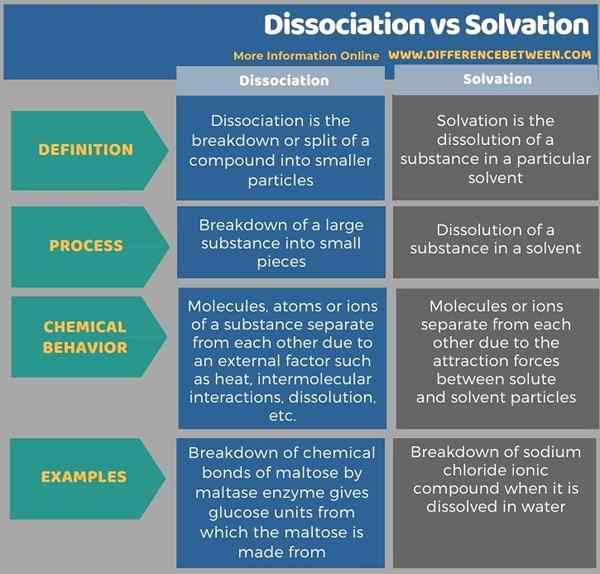
Résumé - Dissociation vs solvatation
La principale différence entre la dissociation et la solvatation est que la dissociation est la dégradation d'une substance en atomes ou ions à partir desquels la substance est faite tandis que la solvatation est la dissolution d'une substance dans un solvant en raison des forces d'attraction entre les molécules de solvant et les composants de la substance.
Référence:
1. «Solutions, solvatation et dissociation.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
2. «Solvatation et dissociation."Socratic.org, disponible ici.
Image gracieuseté:
1. «Broh Acid Dissociation» par ACHOW801 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia
2. «214 Dissociation du chlorure de sodium dans Water-01» par OpenStax College - Anatomy & Physiology, Connexions Web Site, 19 juin 2013 (CC par 3.0) via Commons Wikimedia


