Différence entre les réactions concertées et pas à pas
Le différence clé entre les réactions concertées et pas à pas est que Les réactions concertées sont des réactions en une seule étape, tandis que les réactions pas à pas sont des réactions en plusieurs étapes.
Les termes réactions concertées et pas à pas relèvent du domaine de la chimie physique où les taux de réactions sont déterminés en utilisant le changement dans le réactif et le produit s'étend avec le temps. Toutes les réactions chimiques que nous connaissons peuvent être classées en deux groupes différents comme des réactions concertées et des réactions pas à pas en fonction du mécanisme de la réaction.
CONTENU
1. Aperçu et différence clé
2. Quelles sont les réactions concertées
3. Quelles sont les réactions pas à pas
4. Comparaison côte à côte - réactions concernées vs pas en étape sous forme tabulaire
5. Résumé
Quelles sont les réactions concertées?
Les réactions concertées sont des réactions chimiques qui n'impliquent qu'une seule étape. Cela signifie; Toutes les réactions en une seule étape relèvent de la catégorie des réactions concertées. Par conséquent, les réactions de rupture et de formation de liaisons se produisent simultanément pour former les produits. En d'autres termes, il n'y a pas d'intermédiaires réactifs ou de complexes d'énergie haute instable formés pendant ce type de réactions chimiques.
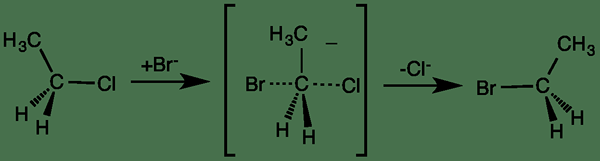
Figure 01: Un exemple de réaction concertée (contient un intermédiaire instable)
Généralement, les réactions concertées ne dépendent pas de la polarité du solvant, et le mécanisme de la réaction est nommé comme mécanisme concerté. Certains exemples courants pour ce type de réactions comprennent les réactions péricycliques, les réactions SN2 et certaines réactions de réarrangement telles que le réarrangement Claisen.
Quelles sont les réactions pas à pas?
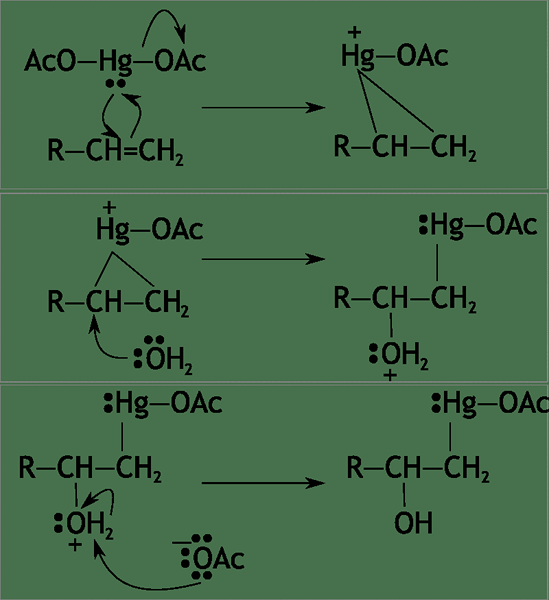
Les réactions pas à pas sont des réactions en plusieurs étapes. Par conséquent, il y a ou plus d'intermédiaires chimiques dans ces réactions. Ces intermédiaires sont généralement très réactifs en raison de l'énergie élevée, ce qui les rend instables. Les réactions pas à pas contiennent généralement deux ou plusieurs réactions élémentaires.

Figure 02: Un exemple de réaction pas à pas
Contrairement aux réactions par étapes, la rupture de liaison et la formation de liaison dans les réactions pas à pas se produisent à différentes étapes (pas en une seule étape). Par conséquent, les réactifs ne peuvent pas se convertir directement en produits. La «réaction globale» dans une réaction pas à pas qui donne la conversion des réactifs en produits. Nous pouvons obtenir la réaction globale en équilibrant avec précision toutes les étapes de la réaction pas à pas. Néanmoins, il y a une réaction élémentaire dans une réaction pas à pas qui détermine la vitesse de la réaction. C'est la réaction la plus lente de la série de réaction, et il peut ou non avoir des réactifs ou des produits impliqués (il ne peut contenir que des intermédiaires de la réaction).
Quelle est la différence entre les réactions concertées et pas à pas?
Les termes réactions concertées et pas à pas relèvent du domaine de la chimie physique où les taux de réactions sont déterminés en utilisant le changement dans le réactif et le produit s'étend avec le temps. La principale différence entre les réactions concertées et pas à pas est que les réactions concertées sont des réactions en une seule étape, tandis que les réactions pas à pas sont des réactions en plusieurs étapes. L'étape de détermination du taux d'une réaction concertée est elle-même une réaction concertée. Mais, dans les réactions pas à pas, la réaction élémentaire la plus lente est l'étape de détermination du taux.
De plus, il n'y a pas d'intermédiaires de réaction dans les réactions concertées car les réactifs se convertissent directement en produits. Cependant, dans les réactions par étapes, il existe un ou plusieurs composés intermédiaires qui sont très instables en raison du niveau d'énergie élevé du composé. La réaction globale d'une réaction pas à pas donne la conversion des réactifs en produits.
L'infographie ci-dessous fournit plus de détails sur la différence entre les réactions concertées et pas à pas.
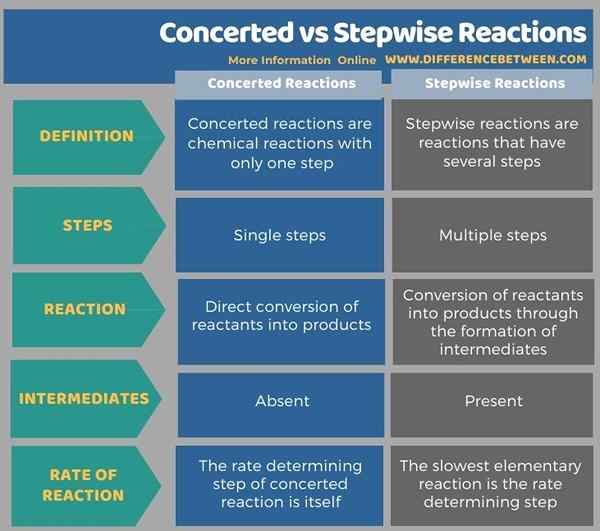
Résumé - Réactions concertées vs pas à pas
Toutes les réactions chimiques que nous connaissons peuvent être classées en deux groupes comme des réactions concertées et des réactions pas à pas. La principale différence entre les réactions concertées et pas à pas est que les réactions concertées sont des réactions en une seule étape, tandis que les réactions pas à pas sont des réactions en plusieurs étapes.
Référence:
1. «Réaction concertée.”Chemistry LibreTexts, LibreTexts, 5 juin 2019, disponible ici.
2. «Réaction concertée.»Wikipedia, Wikimedia Foundation, 2 juin 2017, disponible ici.
Image gracieuseté:
1. «SN2ETCL + BROMIDE» par Smokefoot - Propre travaux (CC BY-SA 3.0) via Commons Wikimedia
2. «OxymerCury Stepwise» par thejackal à l'anglais wikipedia - transféré de EN.Wikipedia à Commons par Ronhjones en utilisant CommonShelper (domaine public) via Commons Wikimedia


