Différence entre la combinaison et la réaction de décomposition

Différence clé - combinaison vs réaction de décomposition
Une réaction chimique est la conversion d'un ou plusieurs composés chimiques en un ou plusieurs produits différents, modifiant l'identité d'un composé chimique. Le matériau de départ d'une réaction chimique est appelé réactif et le composé résultant est appelé le produit. Une dégradation des composés ou une combinaison de composés et la formation de nouveaux composés se produiront pendant un processus de réaction chimique car les liaisons entre les atomes du composé sont cassées et créées d'une manière différente. Les réactions chimiques peuvent être divisées en plusieurs grandes catégories. Les réactions redox ou les réactions d'oxydation-réduction sont très importantes parmi elles. Les réactions d'oxydation et de réduction sont appelées réactions de transfert d'électrons car les électrons des réactifs sont transférés d'un composé à l'autre pour provoquer la réaction. Dans les réactions redox, deux réactions parallèles, appelées demi-réactions, se produisent en même temps. Ces demi-réactions montrent le transfert d'électrons. En équilibrant ces demi-réactions, on peut deviner la réaction globale qui s'est produite à la fin. Les réactions combinées et les réactions de décomposition sont deux principaux types de réactions redox. La principale différence entre la combinaison et la réaction de décomposition est que La réaction combinée implique une combinaison de réactifs pour donner un seul produit alors que La réaction de décomposition implique la dégradation d'un seul composé en deux produits ou plus.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce qu'une réaction combinée
3. Qu'est-ce qu'une réaction de décomposition
4. Comparaison côte à côte - combinaison vs réaction de décomposition
5. Résumé
Qu'est-ce qu'une réaction combinée?
Une réaction combinée, également appelée réaction de synthèse, est une réaction dans laquelle les composés réactifs sont combinés pour former un composé différent comme le produit. En d'autres termes, la réaction des molécules simples se traduit par une molécule complexe. Certaines ou toutes les liaisons entre les atomes de ce composé particulier sont décomposées; Dans le même temps, les atomes se combineront pour former le nouveau composé, qui est le produit. Dans les réactions de décomposition, le même réactif agit que le matériau de départ pour les deux demi-réactions. Contrairement aux réactions de décomposition, les demi-réactions dans les réactions combinées ont des réactifs différents pour commencer. Réaction combinée entraîne un seul produit. Voici un exemple courant qui peut être donné en tant que réactions de combustion.
Par exemple, lorsque l'aluminium (AL) est placé dans du bromure liquide (BR2) Une réaction combinée se produit et produit du bromure d'aluminium (Albr3). Ici, le nombre d'oxydation est augmenté en Al et diminué en Br. Par conséquent, c'est une réaction redox et une réaction combinée car deux réactifs ont réagi pour donner un produit particulier.
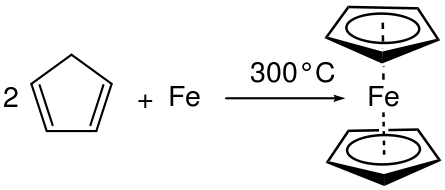
Figure 01: Réaction combinée
Qu'est-ce que la réaction de décomposition?
La réaction de décomposition est une autre réaction importante dans la catégorie des réactions redox. C'est fondamentalement l'opposé de la réaction combinée. Une réaction de décomposition est une réaction où le composé réactif est décomposé en produits. Ici, les demi-réactions se produisent en même temps que la réaction d'oxydation et la réaction de réduction. Mais contrairement à la réaction combinée, le réactif pour les deux demi-réactions est le même dans les réactions de décomposition. La réaction de décomposition se traduit par plusieurs produits.
Dans l'électrolyse de l'eau, lorsque le courant direct passe dans l'eau, les molécules d'eau sont décomposées pour donner de l'oxygène et des gaz hydrogène. Ici, le nombre d'oxydation est augmenté dans l'atome d'oxygène et est diminué dans l'atome d'hydrogène. Par conséquent, il s'agit d'une réaction redox et d'une réaction de décomposition due à la dégradation des molécules d'eau en oxygène et en gaz d'hydrogène.

Figure 02: combinaison vs décomposition
Quelle est la différence entre la combinaison et la réaction de décomposition?
Combinaison vs réaction de décomposition | |
| Deux composés réactifs ou plus sont impliqués dans des réactions combinées. | Un seul composé est impliqué dans une réaction de décomposition. |
| Des produits | |
| Réaction combinée entraîne un seul produit. | Les réactions de décomposition entraînent plusieurs produits. |
| Demi-réactions | |
| Dans les réactions combinées, deux demi-réactions ont deux molécules de départ différentes. | Dans les réactions de décomposition, une seule molécule agit comme le matériau de départ pour les deux demi-réactions. |
| Liaisons chimiques | |
| Les réactions combinées entraînent une liaison des atomes pour produire le produit à un seul extrémité. | Dans les réactions de décomposition, les liaisons chimiques sont décomposées pour former deux produits finaux ou plus. |
| Molécules | |
| Les réactions combinées provoquent la réaction de molécules simples et produisent des molécules complexes. | Les réactions de décomposition provoquent la décomposition des molécules complexes en molécules simples. |
Résumé - combinaison vs réaction de décomposition
Les réactions redox font partie du monde qui nous entoure parce que la majorité des réactions chimiques importantes sont des réactions redox. Les réactions combinées et les réactions de décomposition sont des réactions simples qui sont opposées les unes aux autres. La principale différence entre la combinaison et la réaction de décomposition est que la réaction de combinaison implique la combinaison de deux ou plusieurs molécules de réactif pour entraîner un seul produit final tandis que la réaction de décomposition implique la dégradation d'une seule molécule en deux produits ou plus.
Les références:
1.Chang, R., 2010. chimie. 10e édition. Newyork: McGraw-Hill.
2.Redox. (2009, 30 juillet). Récupéré le 29 mai 2017 de HTTPS: // Faible Interactions.wordpress.com / amorces / redox /
3.Réactions. (n.d.). Récupéré le 29 mai 2017 de http: // www.ric.edu / faculté / ptiskus / réactions /
Image gracieuseté:
1. «Miller Ferrocen Synthese» par Bert.Kilanowski - Propre travaux (CC0) via Commons Wikimedia
2. «Réactions chimiques» de Daniele Pugliesi - Propre travaux (CC By-SA 3.0) via les communes Wikimedia [Cropped]


