Différence entre le butane et l'isobutane

Butane vs isobutane
Les molécules organiques sont des molécules composées de carbones. Les hydrocarbures sont des molécules organiques, qui se composent uniquement d'atomes de carbone et d'hydrogène. Les hydrocarbures peuvent être aromatiques ou aliphatiques. Ils sont principalement divisés en quelques types comme alcanes, alcènes, alcynes, cycloalcanes et hydrocarbures aromatiques. L'hexane et le n-hexane sont des alcanes ou autrement, appelés hydrocarbures saturés. Ils ont le plus grand nombre d'atomes d'hydrogène, qu'une molécule peut accueillir. Toutes les liaisons entre les atomes de carbone et les hydrogènes sont des liaisons uniques. Pour cette raison, la rotation des liaisons est autorisée entre tous les atomes. Ils sont le type d'hydrocarbures le plus simple. Les hydrocarbures saturés ont la formule générale de CnH2n + 2. Ces conditions diffèrent légèrement pour les cycloalcanes car elles ont des structures cycliques.
Butane
Comme indiqué ci-dessus, l'hydrocarbure butane est un alcane saturé. Il a quatre atomes de carbone; Par conséquent, a la formule moléculaire de C4Hdix. La masse molaire de butane est de 58.12 g mol−1. Le point de fusion du butane est de 133-139 K et le point d'ébullition est de 272-274 K. Le butane est le nom commun utilisé pour indiquer toutes les molécules avec cette formule. Il y a deux isomères structurels que nous pouvons dessiner pour correspondre à cette formule mais, dans la nomenclature IUPAC, nous utilisons spécifiquement le butane pour indiquer une molécule non ramifiée, qui est également connue sous le nom de n-butane n-butane. Il a la structure suivante.

D'autres isomères structurels sont comme une molécule méthylée de propane. Il est connu sous le nom d'isobutane. Le butane est un gaz incolore. Il peut être facilement liquéfié. Le gaz butane est très inflammable. Le butane est un composant du gaz naturel, et il est produit lorsque l'essence est raffinée. Lors de la combustion complète, le butane produit du dioxyde de carbone et de l'eau. Cependant, s'il n'y a pas assez d'oxygène de gaz pour la combustion, il produit du monoxyde de carbone et de l'eau à partir de combustion partielle. Le butane est utilisé comme carburant. Lors de la production de gaz LP, le butane est mélangé avec du propane et d'autres hydrocarbures. Ceux-ci sont utilisés à des fins de cuisine au ménage. Il est également utilisé dans les briquets.
Isobutane
L'isobutane est un isomère structurel du butane. Il a la même formule moléculaire que le butane, mais la formule structurelle est différente. Il est également connu sous le nom de méthylpropane. Il a la structure suivante.
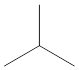
L'isobutane a un carbone tertiaire, et c'est la molécule la plus simple avec un carbone tertiaire. L'isobutane est un gaz transparent incolore, inodore et transparent. Le point de fusion de l'isobutane est de 40-240 K, et le point d'ébullition est de 260-264 K. Il est principalement utilisé comme réfrigérant. Une forme pure d'isobutane est utilisée dans les réfrigérateurs. De plus, il est utilisé comme propulseur dans les pulvérisations d'aérosol.
| Quelle est la différence entre le butane et l'isobutane? • L'isobutane est un isomère structurel du butane. • Le butane n'est pas ramifié et l'isobutane est ramifié. • Les deux ont la même formule moléculaire, mais la formule structurelle est différente. • Butane a quatre atomes de carbone dans la chaîne droite, tandis que l'isobutane n'a que trois atomes de carbone dans la chaîne droite. • Les propriétés physiques du butane et de l'isobutane sont différentes. Par exemple, ils ont différents points de fusion, points d'ébullition, densité, etc. • L'isobutane pur est principalement utilisé comme réfrigérant |


