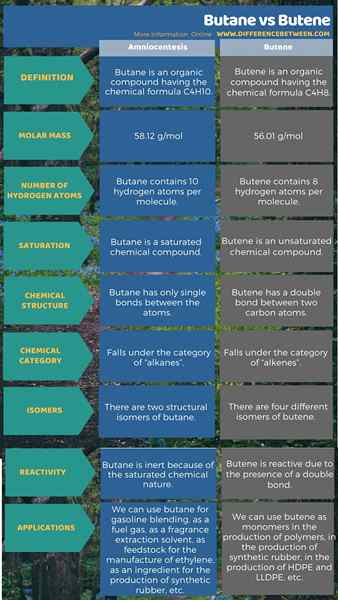
Différence entre le butane et Bunene
Le différence clé entre le butane et le butène est que le Le butane n'a pas de liaisons doubles ou triples entre les atomes de carbone tandis que le butène contient une double liaison entre les atomes de carbone.
Le butane et le butène sont des composés organiques qui ont quatre atomes de carbone par molécule. Mais ils ont des différences dans leurs structures chimiques telles que leur liaison chimique et un certain nombre d'atomes d'hydrogène. Par conséquent, ils ont également des propriétés chimiques et physiques différentes.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le butane
3. Qu'est-ce que Butene
4. Comparaison côte à côte - butane vs butène sous forme tabulaire
5. Résumé
Qu'est-ce que le butane?
Le butane est un composé organique ayant la formule chimique C4Hdix. C'est un alcane; Ainsi, c'est un composé saturé. Par conséquent, il n'y a pas de liaisons doubles ou triples entre les atomes de cette molécule. Il existe comme un gaz à température ambiante et à la pression. Ce composé a quatre atomes de carbone et 10 atomes d'hydrogène. Ces atomes s'organisent dans une structure linéaire ou une structure ramifiée. Nous appelons la structure linéaire comme «n-butane» et la structure ramifiée comme «isobutène». Cependant, selon le système de nomenclature IUPAC, le terme butane fait référence à la forme linéaire. L'isobutène a une branche méthyle attachée à une colonne vertébrale à trois carbone.
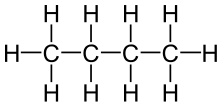
Figure 01: Structure chimique du n-butane
La masse molaire de ce gaz est 58.12 g / mol. C'est un gaz incolore. Il a une odeur d'essence. La fusion et les points d'ébullition sont respectivement de −134 ° C et 1 ° C. En plus de cela, ce gaz est un gaz très inflammable et facilement liquéfié. Lorsqu'il est liquéfié, il se vaporise rapidement à température ambiante. Lorsqu'il y a suffisamment d'oxygène, ce gaz brûle, donnant du dioxyde de carbone et de la vapeur d'eau. Mais si la quantité d'oxygène est limitée, elle forme également de la suie en carbone et du monoxyde de carbone; En raison d'une combustion incomplète.
Lorsque vous envisagez les utilisations du butane, nous pouvons l'utiliser pour le mélange d'essence, comme un gaz carburant, comme solvant d'extraction de parfum, comme matière première pour la fabrication d'éthylène, comme ingrédient pour la production de caoutchouc synthétique, etc.
Qu'est-ce que Butene?
Butene est un composé organique ayant la formule chimique C4H8. «Butylène» est synonyme du même composé. Ce composé a quatre atomes de carbone et 8 atomes d'hydrogène. Il y a une double liaison entre deux atomes de carbone. Par conséquent, c'est un composé insaturé. Il relève de la catégorie des alcènes. C'est un gaz incolore à température ambiante et à la pression. Nous pouvons trouver ce gaz comme un constituant mineur en pétrole brut. Ainsi, nous pouvons obtenir ce composé via la fissuration catalytique dans une raffinerie.
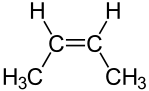
Figure 02: (2Z) -BUT-2-ENE ISOMER DE BUTENE
En raison de la présence de la double liaison, ce composé a des isomères. Il y a quatre isomères majeurs; Ils sont, But-1-ENE, (2Z) -BUT-2-ENE, (2E) -BUT-2-ENE et 2-Méthylprop-1-ENE (isobutylène). Tous ces isomères existent sous forme de gaz. Nous pouvons les liquéfier par deux méthodes; Nous pouvons abaisser la température ou augmenter la pression. Ces gaz ont des odeurs distinctes. De plus, ils sont très inflammables. La double liaison rend ces composés plus réactifs que les alcanes avec un nombre similaire d'atomes de carbone. Lorsque vous envisagez les applications de ce composé, nous pouvons les utiliser comme monomères dans la production de polymères, dans la production de caoutchouc synthétique, dans la production de HDPE et LLDPE, etc.
Quelle est la différence entre le butane et le butène?
Le butane est un composé organique ayant la formule chimique C4Hdix Et Butene est un composé organique ayant la formule chimique C4H8. Ce sont des composés organiques contenant quatre atomes de carbone et différents nombres d'atomes d'hydrogène. Principalement, la principale différence entre le butane et le butène est dans leurs structures chimiques. C'est-à-dire qu'une double liaison est présente dans le buteur, mais est absente dans le butane. De plus, cela rend Butene plus réactif tout en donnant une inertie au butane. De plus, Butene a quatre isomères différents tandis que le butane a seulement deux isomères.
L'infographie ci-dessous présente plus de détails sur la différence entre la forme tabulaire du butane et de la buténeine.

Résumé - Butane vs Butene
Le butane et le butène sont des composés organiques qui existent sous forme de gaz à température ambiante et à la pression. La principale différence entre le butane et le butène est que le butane n'a pas de liaisons doubles ou triples entre les atomes de carbone tandis que le butène contient une double liaison entre les atomes de carbone.
Référence:
1. "Butane.»Wikipedia, Wikimedia Foundation, 22 août. 2018. Disponible ici
2. «Butene.»Wikipedia, Wikimedia Foundation, 22 août. 2018. Disponible ici
Image gracieuseté:
1.«Butan Lewis» par Neurotiker ⇌ - Propre travaux, (domaine public) via Commons Wikimedia
2.«CIS-2-Buten» par Neurotiker - Propre travaux, (domaine public) via Commons Wikimedia


