Différence entre le chlore et le dioxyde de chlore

Le différence clé entre le chlore et le dioxyde de chlore est que L'état d'oxydation de l'atome de chlore dans le chlore ou le chlore gazeux est nul tandis que l'état d'oxydation de l'atome de chlore dans le dioxyde de chlore est +4 est +4. De plus, la différence physique entre le chlore et le dioxyde de chlore est que le chlore est un gaz jaune pâle-vert avec une odeur piquante et irritante tandis que le dioxyde de chlore est un gaz jaune à rougeâtre avec une odeur âcre.
Le chlore et le dioxyde de chlore sont des composés gazeux. Ils ont des propriétés chimiques et physiques différentes et donc, différentes applications. Étant donné que le chlore est un élément chimique du groupe 7, l'état d'oxydation le plus courant est -1. Cependant, l'atome de chlore dans le dioxyde de chlore a l'état d'oxydation +4.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que le chlore
3. Qu'est-ce que le dioxyde de chlore
4. Comparaison côte à côte - chlore vs dioxyde de chlore sous forme tabulaire
6. Résumé
Qu'est-ce que le chlore?
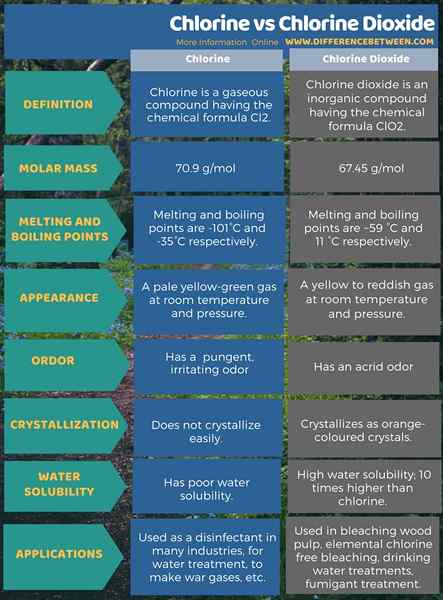
Le chlore est un composé gazeux ayant la formule chimique CL2. C'est un gaz jaune pâle à température ambiante et la pression. Il agit comme un agent extrêmement réactif, c'est donc un fort agent oxydant. De plus, il a une odeur piquante et irritante. Cette odeur est similaire à Bleach. Le nom IUPAC de ce gaz est le «chlore moléculaire».

Figure 01: Couleur de gaz du chlore
La masse molaire de chlore gazeux est de 70.9 g / mol. Les deux atomes de chlore de cette molécule sont liés de manière covalente. Nous l'appelons un «gaz diatomique» car il y a deux atomes liés les uns aux autres pour une molécule. L'inhalation de ce gaz est toxique et c'est aussi un irritant à l'œil. Le gaz est légèrement soluble dans l'eau et peut se liquéfier à -35 ° C. Cependant, nous pouvons facilement liquéfier ce gaz en appliquant une pression appropriée à température ambiante. De plus, ce gaz n'est pas inflammable, mais il peut soutenir la combustion.
Plus important encore, ce gaz est toxique si nous l'inhalons. Le chlore gazeux est plus lourd que l'air normal. Ainsi, il a tendance à se rassembler dans les zones inférieures de l'atmosphère. Les points de fusion et d'ébullition sont respectivement de -101 ° C et -35 ° C. Il est utile comme désinfectant dans de nombreuses industries, pour le traitement de l'eau, pour faire des gaz de guerre, etc.
Qu'est-ce que le dioxyde de chlore?
Le dioxyde de chlore est un composé inorganique ayant la formule chimique CLO2. C'est un gaz jaune à rougeâtre. Ce gaz cristallise à -59 ° C qui apparaît sous forme de cristaux de couleur orange. C'est un oxyde commun de chlore. La masse molaire est 67.45 g / mol. Il a une odeur âcre. Les points de fusion et d'ébullition sont respectivement de -59 ° C et 11 ° C. Ceci est un composé neutre et est très différent du chlore élémentaire. Il a une solubilité en eau très élevée. Surtout il peut se dissoudre dans l'eau froide. La solubilité est environ 10 fois plus élevée que le chlore gazeux. De plus, il n'hydrolyze pas lorsque nous le dissolvons dans l'eau. Par conséquent, il reste un gaz dissous dans l'eau. L'état d'oxydation de l'atome de chlore dans cette molécule est +4. Puisque cette molécule a un nombre impair d'électrons, il est paramagnétique.

Figure 02: dioxyde de chlore liquéfié
Les principales applications de ce gaz incluent dans la pulpe de bois de blanchiment, à des fins de blanchiment sans chlore élémentaires, les traitements en eau potable, comme traitement fumigent, etc.
Quelle est la différence entre le chlore et le dioxyde de chlore?
Le chlore est un composé gazeux ayant la formule chimique CL2. D'un autre côté, le dioxyde de chlore est un composé inorganique ayant la formule chimique CLO2. Les points de fusion et d'ébullition du chlore gazeux sont très faibles par rapport au dioxyde de chlore. Plus important encore, le dioxyde de chlore est fortement soluble dans l'eau; il se dissout même dans l'eau froide. Cette solubilité est environ 10 fois plus élevée que celle du chlore gazeux. Ces deux composés dérivent de l'élément de chlore. La principale différence entre le chlore et le dioxyde de chlore est que l'état d'oxydation de l'atome de chlore dans le chlore gazeux est nul tandis que l'état d'oxydation de l'atome de chlore dans le dioxyde de chlore est de +4.
L'infographie ci-dessous présente plus de détails sur la différence entre le chlore et le dioxyde de chlore sous forme tabulaire.
Résumé - chlore vs dioxyde de chlore
Le chlore et le dioxyde de chlore sont des composés gazeux à température ambiante et à la pression. La différence entre le chlore et le dioxyde de chlore est que l'état d'oxydation de l'atome de chlore dans le chlore gazeux est nul tandis que l'état d'oxydation de l'atome de chlore dans le dioxyde de chlore est de +4.
Référence:
1. "Chlore.»Information du Centre national pour la biotechnologie. Base de données de composés PubChem, u.S. Bibliothèque nationale de médecine. Disponible ici
2. «Dioxyde de chlore.»Wikipedia, Wikimedia Foundation, 22 août. 2018. Disponible ici
Image gracieuseté:
1.«Chlore ampoule» par w. Oelen (CC BY-SA 3.0) via Commons Wikimedia
2.«Solution de dioxyde de chlore» MEð Iridos - Propre travaux, (domaine public) via Commons Wikimedia


