Différence entre l'économie des atomes et le pourcentage de rendement
Différence clé - Économie des atomes vs pourcentage de rendement
L'économie des atomes et le pourcentage de rendement sont utilisés pour déterminer l'efficacité de la synthèse chimique. La détermination de l'économie des atomes est très importante car elle donne des détails sur la façon dont le processus est vert. Il indique également le gaspillage d'atomes pendant le processus. Le rendement en pourcentage est la quantité de produit donné par une réaction chimique par rapport à la quantité calculée attendue (le montant théorique). La principale différence entre l'économie des atomes et le pourcentage de rendement est que L'économie atomique est calculée en divisant la masse molaire du produit souhaité par la masse molaire de tous les réactifs tandis que le pourcentage de rendement est calculé en plongeant le rendement réel du produit à partir du rendement théorique du produit.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'économie de l'atome
3. Qu'est-ce que le pourcentage de rendement
4. Similitudes entre l'économie des atomes et le pourcentage de rendement
5. Comparaison côte à côte - Économie des atomes vs pourcentage de rendement sous forme tabulaire
6. Résumé
Qu'est-ce que l'économie de l'atome?
Économie atome ou efficacité de l'atome est la détermination de l'efficacité d'une synthèse chimique par rapport aux atomes utilisés pendant la réaction de synthèse. Si l'économie des atomes est à 100%, cela signifie que tous les atomes impliqués dans le processus ont été utilisés pendant le processus. Cela signifie que tous les atomes des réactifs ont été convertis en atomes du produit. Si l'économie atome d'un processus est élevée, elle est appelée un procédé vert.
Équation du calcul de l'économie des atomes
La détermination de l'économie des atomes peut être effectuée via l'équation suivante.
Économie atome = (masse molaire de la masse de produit / molaire souhaité de tous les réactifs) x 100%

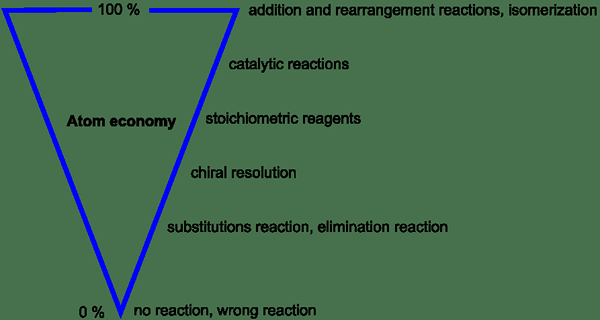
Figure 1: Variation de l'économie des atomes basée sur différents paramètres
Dans un processus idéal, tous les atomes des réactifs sont utilisés par le processus et sont convertis en réactifs. Par conséquent, aucun atome n'est gaspillé. Mais dans les processus réels, l'économie des atomes est inférieure à 100%. Cela est dû à la production de sous-produits au lieu de ne donner que le produit souhaité. C'est une préoccupation majeure en ce qui concerne le processus qui consomme des matières premières à coût élevé.
Exemple
Production d'anhydride maléique à partir de benzène. Il s'agit d'une réaction d'oxydation; Les réactifs impliqués dans le processus sont le benzène et l'oxygène moléculaire.
Benzène + 4.5oxygène → Anhydride maléique + dioxyde de 2 carbone + 2 eau
Masse molaire du produit souhaité = (12 × 4) + (16 × 3) + (1 × 2)
= 98 g / mol
Masse molaire de tous les réactifs; benzène = (12 × 6) + (1 × 6)
= 78 g / mol
Oxygène moléculaire = 4.5 (16 × 2)
= 144 g / mol
La masse totale des réactifs = 78 + 144
= 222 g / mol
Économie des atomes = (98/222) x 100%
= 44.14%
Qu'est-ce que le pourcentage de rendement?
Pourcentage de rendement (également appelé pourcentage de rendement) est le rendement réel obtenu à partir d'une réaction de synthèse chimique, en ce qui concerne le rendement théorique. La valeur est donnée en pourcentage. Le rendement réel est ce que nous obtenons de l'expérience tandis que le rendement théorique est la valeur calculée à partir de l'équation de la réaction chimique, compte tenu de la stoechiométrie.
Lors du calcul du rendement théorique, il faut considérer le réactif limitant. Le réactif limitant ou le réactif limitant est le réactif qui détermine la quantité de produit fabriquée. Le réactif limitant est consommé pendant la réaction où d'autres réactifs restent même après l'achèvement de la réaction car ce sont des réactifs en excès.
Comment trouver le réactif limitant?
Ex: Considérons la réaction entre Al (14 g) et Cl2 (4.25 g) gaz. Le produit final est alcl3.
2Al + 3Cl2 → 2Alcl3
Les moles d'Al présents = 14/26.98 = 0.52 mol
Les moles de Cl2 présent = 4.25/70.90 = 0.06 mol
Rapport stoichiométrique entre Al et Cl2 = 2: 3
Par conséquent, 2 moles d'Al réagissent avec 3 moles de Cl2. Puis quantité de cl2 requis pour réagir avec 0.52 mol d'al est = (3/2) x 0.52 = 0.78 mol
Mais seulement 0.06 mol est présent. Par conséquent, Cl2 Le réactif limitant est-il ici. Ensuite, le rendement théorique est calculé en utilisant la quantité d'Al présente dans le mélange réactionnel.
Rendement théorique = (2/3) x 0.06 x 133.3 = 5.33 g
Si le rendement réel obtenu de l'expérience est donné comme 4.33g, alors le pourcentage de rendement peut être calculé comme suit.
Pourcentage de rendement = (4.33/5.33) x 100% = 81.24%
Quelles sont les similitudes entre l'économie des atomes et le pourcentage de rendement?
- L'économie atomique et le pourcentage de rendement sont des pourcentages.
- L'économie des atomes et le pourcentage de rendement sont très utiles pour déterminer l'efficacité d'un processus chimique.
Quelle est la différence entre l'économie des atomes et le pourcentage de rendement?
Économie atomique vs pourcentage de rendement | |
| L'économie des atomes est la détermination de l'efficacité d'une synthèse chimique par rapport aux atomes utilisés pendant la réaction de synthèse. | Le rendement en pourcentage est le rendement réel obtenu à partir d'une réaction de synthèse chimique, en ce qui concerne le rendement théorique. |
| But | |
| L'économie des atomes est calculée pour estimer l'efficacité d'un processus et déterminer le gaspillage des atomes. | Le rendement en pourcentage est calculé pour déterminer la quantité de produit donné pratiquement par rapport aux attentes théoriques. |
| Calcul | |
| L'économie atome est calculée en divisant la masse molaire du produit souhaité par la masse molaire de tous les réactifs | Le rendement en pourcentage est calculé en plongeant le rendement réel du produit à partir du rendement théorique du produit. |
Résumé - Économie des atomes vs pourcentage de rendement
L'économie des atomes et le pourcentage de rendement sont des valeurs de pourcentage calculées concernant les réactions chimiques. The key difference between atom economy and percentage yield is that atom economy is calculated by dividing the molar mass of the desired product by the molar mass of all the reactants whereas percentage yield is calculated by diving the actual yield of the product from the theoretical yield of le produit.
Référence:
1. «Limiter les réactifs et le pourcentage de rendement.»Khan Academy, disponible ici.
2. «Économie atomique.»Wikipedia, Wikimedia Foundation, 28 février. 2018, disponible ici.
Image gracieuseté:
1.«Atom Economy v3 en» par Astrid 91 - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


