Différence entre Arrhenius et Eyring Equation

Le différence clé Entre Arrhenius et l'équation d'Eyring est que L'équation d'Arrhenius est une équation empirique tandis que l'équation Eyring est basée sur la justification mécanique statistique.
L'équation d'Arrhenius et l'équation d'Eyring sont deux équations importantes en chimie physique. Lorsque nous supposons une enthalpie d'activation constante et une entropie constante de l'activation, l'équation d'Eyring est similaire à l'équation empirique d'Arrhenius.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'équation d'Arrhenius
3. Qu'est-ce que l'équation Eyring
4. Comparaison côte à côte - Arrhenius vs Eyring équation sous forme tabulaire
5. Résumé
Qu'est-ce que l'équation d'Arrhenius?
L'équation d'Arrhenius est une formule chimique qui implique la dépendance à la température des taux de réaction. Cette équation a été proposée et développée par le scientifique Svante Arrhenius en 1889. L'équation d'Arrhenius a de nombreuses applications pour déterminer le taux de réactions chimiques et dans le calcul de l'énergie d'activation. Dans ce contexte, l'équation d'Arrhenius fournit une justification physique et une interprétation pour la formule. Par conséquent, nous pouvons l'identifier comme une relation empirique. L'équation d'Arrhenius est exprimée comme suit:
K = ae(EA / RT)
Lorsque k est la constante de vitesse pour le mélange réactionnel, t est la température absolue du système en Kelvins, A est le facteur pré-exponentiel pour la réaction chimique, EA est l'énergie d'activation pour la réaction et R est la constante de gaz universelle. Dans cette équation, si l'on considère les unités du facteur pré-exponentiel, A, il est identique aux unités de la constante de vitesse qui dépendra de l'ordre de la réaction. E.g. Si la réaction est un premier ordre, alors les unités de A sont par seconde (S-1). En d'autres termes, dans cette réaction, A est le nombre de collisions par seconde qui se produit dans l'orientation appropriée. De plus, cette relation décrit que l'augmentation de la température ou la diminution de l'énergie d'activation entraînera l'augmentation du taux de réaction.

Figure 01: Différentes dérivés de l'équation d'Arrhenius
Quelle équation d'Eyring?
L'équation d'Eyring est une équation qui décrit les changements dans la vitesse d'une réaction chimique par rapport à la température du mélange réactionnel. Cette équation a été développée par Henry Eyring en 1935 avec deux autres scientifiques. L'équation d'Eyring est similaire à l'équation d'Arrhenius lorsqu'une enthalpie d'activation constante et une entropie constante d'activation sont considérées. La formule générale de l'équation d'Eyring est la suivante:
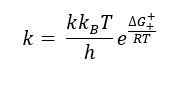
Ici ΔG ‡ est l'énergie de l'activation de Gibbs, κ est le coefficient de transmission, KB est la constante de Boltzmann, et H est la constante de Planck.
Quelle est la différence entre Arrhenius et Eyring Equation?
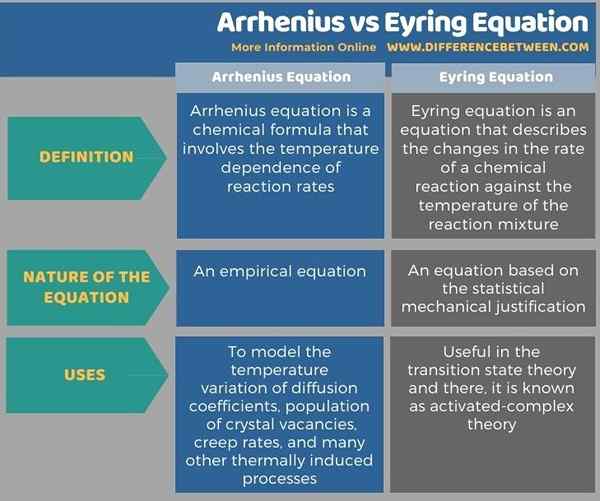
Arrhenius et Eyring équation sont des équations importantes en chimie physique. La principale différence entre Arrhenius et Eyring Equation est que l'équation d'Arrhenius est une équation empirique tandis que l'équation d'Eyring est basée sur la justification mécanique statistique. De plus, l'équation d'Arrhenius est utilisée pour modéliser la variation de la température des coefficients de diffusion, la population des lacunes de cristal, des taux de fluage et de nombreux autres processus induits thermique - Théorie du complexe.
Ci-dessous, l'infographie tabule les différences entre Arrhenius et l'équation d'Eyring pour la comparaison côte à côte.
Résumé - Arrhenius vs Eyring équation
Arrhenius et Eyring équation sont des équations importantes en chimie physique. La principale différence entre Arrhenius et Eyring Equation est que l'équation d'Arrhenius est une équation empirique tandis que l'équation d'Eyring est basée sur la justification mécanique statistique. L'équation d'Arrhenius est utilisée pour modéliser la variation de température des coefficients de diffusion, la population des lacunes en cristal, des taux de fluage et de nombreux autres processus induits thermiquement. L'équation d'Eyring, en revanche, est utile dans la théorie de l'état de transition, et là, elle est connue sous le nom de théorie du complexe activé.
Référence:
1. «6.2.3.1: Équation d'Arrhenius.”Chemistry LibreTexts, LibreTexts, 11 septembre. 2020, disponible ici.
2. «Eyring Equation." Wikipédia, Fondation Wikimedia, 16 octobre. 2020, disponible ici.
Image gracieuseté:
1. «Arrheniusmundim New» par Kleber Carlos Mundim - Propre travaux (CC BY-SA 4.0) via Commons Wikimedia


