Différence entre l'anion et le cation
Le différence clé entre l'anion et le cation est que Les anions sont les ions chargés négativement formés à partir d'atomes neutres tandis que les cations sont des ions chargés positivement formés à partir d'atomes neutres.
Généralement, les anions et les cations sont appelés ions. Les atomes de divers éléments ne sont pas stables (sauf les gaz nobles) dans des conditions normales. Pour devenir stable, ils subissent divers changements chimiques en particulier en ce qui concerne le nombre d'électrons. Par exemple, ils peuvent retirer ou gagner des électrons ou partager des électrons pour gagner la configuration d'électrons stable. Lorsque cela se produit, les éléments ont tendance à se joindre à d'autres éléments. Les éléments chimiques peuvent se joindre les uns aux autres pour former des composés chimiques. Les éléments se lient les uns aux autres via des liaisons chimiques qui ont des caractéristiques ioniques ou covalentes. Si les composés ont des liaisons ioniques, ils sont appelés composés ioniques. Les composés ioniques se forment par l'attraction entre les ions positifs et négatifs.

CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que l'anion
3. Qu'est-ce que le cation
4. Comparaison côte à côte - anion vs cation sous forme tabulaire
5. Résumé
Qu'est-ce que l'anion?
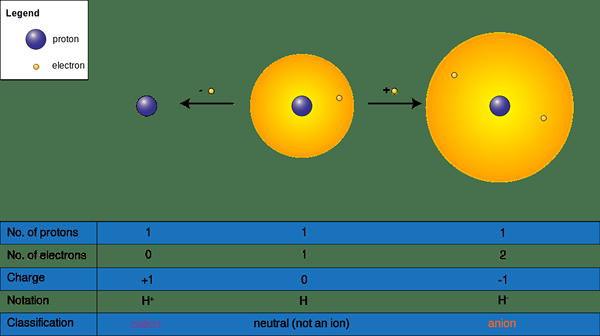
Les anions sont les ions chargés négativement qui se forment à partir d'atomes neutres. Lorsqu'un atome attire un ou plusieurs électrons vers sa forme orbitale extérieure, les ions négatifs. Dans un atome neutre, le nombre d'électrons dans les coquilles externes est égal au nombre de protons dans le noyau. Les électrons sont des particules subatomiques chargées négativement et les protons sont des particules subatomiques chargées positivement. Étant donné que les nombres sont égaux, les atomes n'ont pas de charge nette.
Cependant, lorsqu'un atome attire plus d'électrons de l'extérieur, le nombre d'électrons augmente, donc l'atome devient chargé négativement. Afin d'attirer des électrons, il devrait y avoir d'autres espèces, qui donnent facilement des électrons aux atomes anioniques. Selon le nombre d'électrons gagnés, la taille de la charge varie. Par exemple, si un atome obtient un électron, un anion monovalent se forme et s'il obtient deux électrons sous forme d'anions divalents.

Figure 01: Formation d'ions
Normalement, les anions se forment par des éléments non métalliques, qui se trouvent dans le bloc P du tableau périodique. Par exemple, l'azote forme un anion -3; L'oxygène forme un anion -2 et le chlore forme un anion -1. Ces atomes sont plus électronégatifs, peuvent donc attirer des électrons et former des anions. Non seulement des atomes uniques, mais il peut y avoir plusieurs atomes ou molécules formant ce type d'ions. De plus, si l'anion n'est qu'un atome, il est connu comme un anion monoatomique. Si l'anion a plusieurs atomes, ou s'il s'agit d'une molécule, il est connu comme un anion polyatomique. De plus, ces ions s'attirent vers les champs électriques chargés positivement ou toute espèce chargée positivement.
Qu'est-ce que le cation?
Les cations sont des ions chargés positivement. Ces ions se forment lorsqu'un atome neutre élimine un ou plusieurs électrons. Lorsqu'ils retirent les électrons, le nombre de protons dans les noyaux est plus élevé que le nombre d'électrons dans les coquilles externes; Par conséquent, l'atome obtient une charge positive.
Cations Forme à partir des métaux dans le bloc S, les métaux de transition, les lanthanides et les actinides, etc. Comme les anions, les cations peuvent également avoir différentes tailles de charge en fonction du nombre d'électrons retirés. Par conséquent, ils forment monovalent (na+), Divalent (CA2+), et trivalent (Al3+) Cations. De plus, il peut y avoir des cations monoatomiques ou polyatomiques (NH4+).
Quelle est la différence entre l'anion et le cation?
Anion vs cation | |
| Ions chargés négativement qui se forment à partir d'atomes neutres. | Ions chargés positivement qui se forment à partir d'atomes neutres. |
| Formation | |
| Les anions se forment en attirant des électrons. | Cations former en supprimant les électrons. |
| Espèces chimiques | |
| Les non-métaux font principalement des anions. | Les métaux font des cations. |
| Attraction pour le champ électrique | |
| Attirer les extrémités positives d'un champ électrique. | Attirer les extrémités négatives d'un champ électrique. |
Résumé - Anion vs cation
Les anions et les cations sont des formes d'espèces chimiques chargées. La différence entre l'anion et le cation est que les anions sont les ions chargés négativement formés à partir d'atomes neutres tandis que les cations sont des ions chargés positivement formés à partir d'atomes neutres.
Référence:
1. Helmenstine, Todd. «La différence entre un cation et un anion."Thoughtco, février. 1, 2018. Disponible ici
2. "Ion.»Wikipedia, Wikimedia Foundation, 14 mai 2018. Disponible ici
Image gracieuseté:
1.'Ions' par jkwchui - propre travail, (cc by-sa 3.0) via Commons Wikimedia


