Différence entre la théorie du complexe activé et la théorie des collisions
Le différence clé entre la théorie du complexe activé et la théorie des collisions est que La théorie complexe activée est plus précise et fiable lors de la description des taux de réaction, tandis que la théorie des collisions est moins fiable.
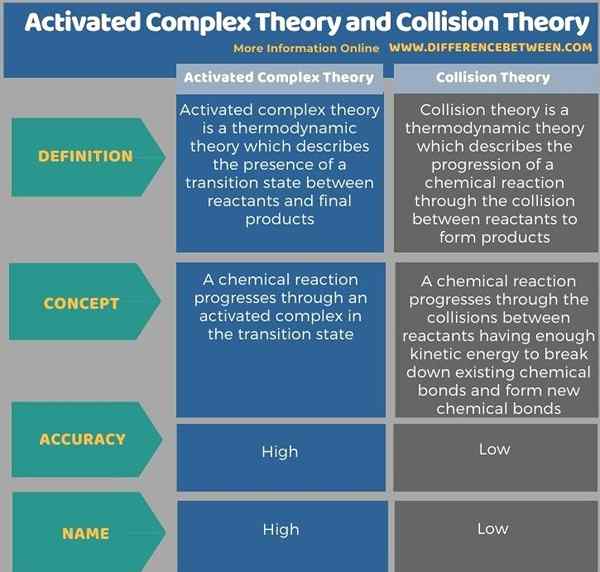
La théorie complexe activée et la théorie des collisions sont deux concepts importants qui décrivent la thermodynamique des réactions chimiques. Ces théories peuvent être utilisées pour prédire les taux de réaction des réactions chimiques. La théorie complexe activée est également nommée comme Théorie de l'état de transition. Cependant, la théorie du complexe activé est considérée comme plus précise par rapport à la théorie des collisions.
CONTENU
1. Aperçu et différence clé
2. Qu'est-ce que la théorie complexe activée
3. Qu'est-ce que la théorie des collisions
4. Comparaison côte à côte - Théorie complexe activée par rapport à la théorie des collisions sous forme tabulaire
5. Résumé
Qu'est-ce que la théorie complexe activée?
La théorie du complexe activé est une théorie thermodynamique qui décrit la présence d'un état de transition entre les réactifs et les produits finaux. Par conséquent, il est également nommé comme la théorie de l'état de transition ou Théorie de la TST. Cette théorie fournit des informations plus précises et fiables par rapport à la théorie des collisions. Cette théorie a été développée par Henry Eyring en 1935.
La théorie du complexe activé décrit l'énergie d'activation (EA) d'un mélange réactionnel et les propriétés thermodynamiques impliquant l'état de transition. Cette théorie est un développement de la théorie des collisions et utilise la base de l'équation d'Arrhenius. De plus, cette théorie décrit le facteur de fréquence statistique, V, qui est un facteur fondamental de cette théorie.
Selon la théorie du complexe activé, il existe un état intermédiaire entre l'état des réactifs et l'état des produits d'un mélange réactionnel. Il est appelé l'état de transition, qui contient un composé complexe activé. Ce complexe activé se forme par la combinaison de réactifs. Selon cette théorie, il y a des faits majeurs que nous devons considérer afin de déterminer si la réaction se produira. Les faits sont les suivants:
- La concentration du complexe activé dans l'état de transition
- Le taux de ventilation de ce complexe activé
- La voie de la ventilation du complexe activé (le complexe peut se décomposer en formant les produits ou il peut à nouveau former des réactifs)
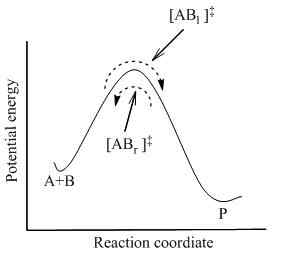
En dehors de cela, la théorie du complexe activé suggère également le concept d'énergie d'activation concernant une réaction chimique. L'énergie d'activation est la barrière d'énergie de la réaction; Une certaine quantité d'énergie est essentielle pour qu'une réaction chimique se produise. Le complexe activé est un complexe d'énergie à haute énergie qui est instable, et il a l'énergie maximale du processus de réaction. Si le mélange réactionnel obtient une quantité d'énergie égale à cette énergie d'activation, le mélange réactionnel peut surmonter la barrière d'énergie et donner des produits de la réaction.
Qu'est-ce que la théorie des collisions?
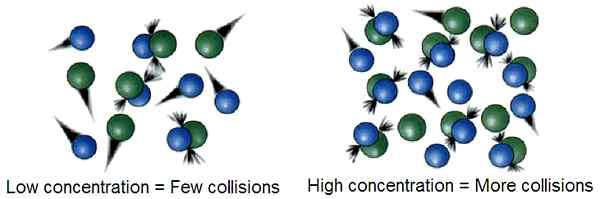
La théorie de la collision est une théorie thermodynamique qui décrit la progression d'une réaction chimique à travers la collision entre les réactifs pour former des produits. Selon cette théorie, si deux molécules entrent en collision les unes avec les autres pour qu'une réaction chimique se produise, les facteurs influençant la facilité de la collision sont importants pour prédire la progression de la réaction. E.g. Plus il y a d'énergie fournie au mélange réactionnel, plus les réactifs se déplacent rapidement, collisant les uns avec les autres. De même, les conditions à haute température peuvent provoquer plus de collisions entre les réactifs et les taux de réaction élevés.

Dans la théorie des collisions, le taux à laquelle les molécules de réactif entrent en collision les unes avec les autres sont nommées comme la fréquence de collision, z. Il donne les unités de collisions par unité de temps. Selon la théorie des collisions, l'énergie du mélange de réactifs et la concentration des réactifs affectent la vitesse de réaction. Cependant, pour qu'une collision réussie entre les réactifs se produise, les réactifs doivent entrer en collision les uns avec les autres avec suffisamment d'énergie cinétique pour décomposer les liaisons chimiques dans les réactifs et former de nouvelles liaisons chimiques, formant le produit final. Cette quantité d'énergie est nommée l'énergie d'activation.
Quelle est la différence entre la théorie complexe activée et la théorie des collisions?
La théorie complexe activée et la théorie des collisions sont des théories thermodynamiques importantes. La principale différence entre la théorie du complexe activé et la théorie des collisions est que la théorie du complexe activé est plus précise et fiable lors de la description des taux de réaction, tandis que la théorie de la collision est moins fiable.
Ci-dessous, l'infographie tabule les différences entre la théorie du complexe activé et la théorie des collisions plus en détail.
Résumé - Théorie complexe activée par rapport à la théorie des collisions
La théorie complexe activée et la théorie des collisions sont des théories thermodynamiques importantes. La principale différence entre la théorie du complexe activé et la théorie des collisions est que la théorie du complexe activé est plus précise et fiable lors de la description des taux de réaction, tandis que la théorie de la collision est moins fiable.
Référence:
1. «Complexe activé." Wikipédia, Fondation Wikimedia, 18 juin 2020, disponible ici.
2. «9.7: Théories des taux de réaction.”Chemistry LibreTexts, LibreTexts, 1er septembre. 2020, disponible ici.
Image gracieuseté:
1. «Quasi-Equilibrium1» par Chem540grp1f08 - propre travail (domaine public) via Commons Wikimedia
2. «Collisions moléculaires» par SADI_CARNOT - (Domaine public) via Commons Wikimedia


